Aminotransferázy
Aminotransferázy jsou enzymy, které katalyzují transaminaci (přenos aminoskupiny z aminokyseliny na ketokyselinu a naopak). V klinické praxi jsou nejdůležitějšími markery alaninaminotransferáza a aspartátaminotransferáza, které odrážejí integritu hepatocytů. Z toho vyplývá, že při poškození jaterního parenchymu dojde ke zvýšení těchto markerů v séru.
Alaninaminotransferáza (ALT)[upravit | editovat zdroj]
Cytoplazmatický enzym, primárně lokalizovaný v játrech, který se uvolňuje při poškození buněčné membrány. Jedná se o vysoce specifický marker pro jaterní onemocnění. Ke zvýšení sérových hodnot dochází již při malém poškození. Dále je obsažen i v kosterních svalech, z čehož vyplývá, že ke zvýšení sérových hodnot dochází i u myopatií.
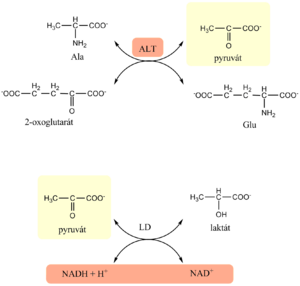
Fyziologickou funkcí ALT je katalýza transaminační reakce, při níž se reverzibilně přenáší aminoskupina z alaninu na 2-oxoglutarát, za vzniku pyruvátu a glutamátu. Kofaktorem je pyridoxal-5´-fosfát.
| Fyziologické hodnoty S-ALT | |
|---|---|
| Muži | do 0,80 μkat/l |
| Ženy | do 0,60 μkat/l |
Sledování ALT je vhodné pro monitoring průběhu onemocnění.
Aspartátaminotransferáza (AST)[upravit | editovat zdroj]
Enzym, který se vyskytuje ve dvou formách – cytoplazmatický (AST1, v jaterním parenchymu asi 20 %) a mitochondriální (AST2, v játrech asi 80 %)[1]. Cytoplazmatická frakce se uvolňuje do cirkulace poměrně snadno, i při mírném poškození buněk. Mitochondriální frakce se dostává do krve teprve při nekróze buňky. Vyskytuje se především v játrech, ale také ho najdeme v kosterním svalstvu, myokardu, ledvinách, mozku, pankreatu a erytrocytech.
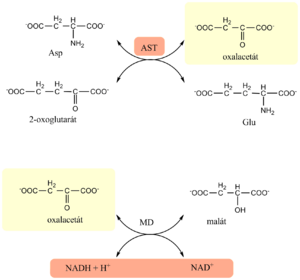
Jeho fyziologickou funkcí je katalýza reverzibilní transaminace z aspartátu na 2-oxoglutarát. Kofaktorem reakce je pyridoxal-5´-fosfát.
Jedná se o poměrně nespecifický ukazatel. Velmi vysoké hodnoty nacházíme u závažného jaterního poškození (virové hepatitidy, polékové a toxické poškození jater, akutní ischémie, cirkulační šok), při kterém bývají zvýšeny i hodnoty ALT. Dále doprovází poškození kosterního svalstva, infarkt myokardu, po operacích, ale i po dlouhotrvající fyzické námaze.
| Fyziologické hodnoty S-AST | |
|---|---|
| Muži | do 0,85 μkat/l |
| Ženy | do 0,60 μkat/l |
Stanovení hodnot ALT a AST[upravit | editovat zdroj]
Pro stanovení koncentrace katalytické aktivity AST a ALT je doporučena metoda založená na principu Warburgova optického testu.
- Stanovení hodnot ALT
- Je založeno na transaminační reakci, která je spřažena s indikační reakcí. Donorem aminoskupiny v transaminační reakci je alanin. Pro indikační reakci používáme enzym laktátdehydrogenázu (LD), která zároveň plní funkci enzymu zabezpečujícího redukci endogenních oxokyselin.
- Postup:
- V první reakci katalyzované ALT vzniká z alaninu pyruvát, který je následně redukován na laktát v indikační reakci katalyzované LD, kterou přidáme do reakční směsi společně s NADH.
- Redukce pyruvátu na laktát je doprovázena úbytkem NADH, který se projeví poklesem absorbance při 334, 340 nebo 365 nm. Katalytická koncentrace ALT je úměrná poklesu absorbance.
- Stanovení hodnot AST
- Je založené podobně jako u ALT na transaminační reakci spřažené s indikační reakcí. Donorem aminoskupiny v transaminační reakci je aspartát, a enzymem pro indikační reakci malátdehydrogenáza (MD).
- Postup:
- V první enzymové reakci, katalyzované AST, se tvoří oxalacetát. Ten je v další indikační reakci redukován malátdehydrogenázou na malát, za současné oxidace NADH na NAD+.
- Na základě úbytku NADH určíme aktivitu AST (úměrná poklesu absorbance při 334, 340 nebo 365 nm).
- V reakční směsi je přítomen pyridoxal-5´-fosfátu, který zabezpečuje dostatečnou saturaci AST a tím i plnou aktivitu enzymu. Přítomnost laktátdehydrogenázy je nezbytná k tomu, aby se zajistila redukce endogenního pyruvátu (zabránění falešně vyšších výsledků).
Klinicko-biochemické využití[upravit | editovat zdroj]
Aminotransferázy jsou součástí tzv. jaterních testů, a významně se uplatňují v diagnostice jaterních onemocnění. Hodnoty jaterních transamináz jsou zvýšeny u většiny jaterních onemocnění. Hodnota ALT obvykle převyšuje hodnotu AST.
Nejvyšší hodnoty nacházíme u akutních virových hepatitid, proto které je charakteristické zvýšení koncentrací AST a ALT na několikanásobnou hodnotu. Vzestup o dvoj- až trojnásobek hodnot lze zaznamenat již v prodromálním stádiu onemocnění. Elevace vrcholí 7.–12. den po nástupu ikteru (maximum až 100 μkat/l). K normalizaci hodnot dochází obvykle 5.–8. týden. Výrazně (řádově desetinásobně), ale jen krátkodobě bývají transaminázy zvýšené při těžkých biliárních kolikách. Ostatní jaterní léze jsou zpravidla doprovázeny mírnějším, maximálně pětinásobným vzestupem aktivity a při chronických onemocněních jater bývají aktivity transamináz často jen těsně nad horní hranicí referenčního rozmezí.
Kromě samotných hodnot v séru, je pro nás důležitým ukazatelem i poměr obou enzymů AST/ALT (de Ritisův index). Hodnoty nad 1 bývají prognosticky závažnější. Hodnoty vyšší než 2 jsou specifické pro alkoholové poškození jater.
Obecně lze říct, že míra vzestupu transamináz odráží rozsah jaterního poškození, ale nelze vyvodit informace o etiologii či jaterní funkci. Také je třeba mít na paměti, že při úbytku funkční jaterní tkáně, např. při cirhóze jater, se může množství buněk snížit natolik, že sérové aktivity transamináz spadají do referenčního rozmezí nebo jen těsně nad něj i při rozsáhlé jaterní lézi.
Odkazy[upravit | editovat zdroj]
Související články[upravit | editovat zdroj]
Použitá literatura[upravit | editovat zdroj]
- ČEŠKA, Richard, et al. Interna. 3. vydání. Praha : TRITON, 2020. 964 s. ISBN 978-80-7553-780-5.
Reference[upravit | editovat zdroj]
- ↑ SEPULVEDA, Jorge L.. Challenges in routine clinical chemistry analysis. In Amitava Dasgupta, Jorge L. Sepulvedatitul. Accurate Results in the Clinical Laboratory. 2. vydání. Elsevier, 2019. s. 141-163. ISBN 9780128137765