Anémie ze snížené tvorby erytrocytů
Anemie z nedostatku železa – sideropenická anémie (mikrocytární, hypochromní)
| Sideropenická anémie | |
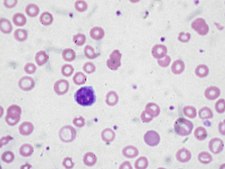 Siderocyty v krevním nátěru | |
| Rizikové faktory | malabsorbce při celiakii, Crohnově chorobě; chronická krvácení |
|---|---|
| Klinický obraz | potíže při polykání, změny nehtů, únava, neurologické příznaky (př. parestezie) |
| Diagnostika | snížená hladina plazmatického železa, nízký sérový ferritin, zvýšený transferinu v plazmě, přítomnost siderocytů, anizocytóza, poikilocytóza |
| Léčba | dodání železa |
| Klasifikace a odkazy | |
Sideropenická anémie vzniká poruchou syntézy hemoglobinu v důsledku nedostatku železa. Jedná se o nejčastější anémii u dětí.[1]
Příčiny vzniku
Nedostatečný přívod železa v potravě je u nás vzácný. Snížený přívod mohou způsobit látky, které inhibují resorpci (fosfáty, fytáty). Častěji se projevuje při malabsorbci (Céliakie, Crohnova choroba, po resekci žaludku či střeva). Dále vzniká při nadměrných ztrátách krví při chronickém krvácení (peptické vředy, hemoroidy, nádorová onemocnění GITu, menorhagie, metrorhagie). Nedostatek železa se také projeví, pokud organismus má zvýšené nároky na krvetvorbu (v těhotenství, v dětství).
- Příčiny sideropenické anémie u dětí
- Porucha absorpce – léčba antacidy, léky zvyšujícímu žaludeční pH, pití čaje a kávy.
- Nedostatečné/nedostupné zásoby železa – krvácení, epistaxe, žaludeční a duodenální vředy, Meckelův divertikl, alergie na bílkovinu kravského mléka, paraziti, infekce Helicobacter pylori, jícnové varixy, nádory a polypy trávicího ústrojí, zánětlivá onemocnění GIT, AV malformace, divertikulitida, hemoroidy, silné menstruační krvácení, infekce/nádory uropoetického traktu, plicní hemosideróza
- Vrozené/získané poruchy metabolismu železa – atransferinémie, poruchy syntézy hemu.[1]
Železo v organismu
V těle jsou celkem 3-4 g železa, většina se nachází v hemoglobinu. Recyklací železa z rozpadajících se erytrocytů se získává 20 mg denně, u dospělého pochází ze stravy < 5 % železa, u kojence 30 %.
Donošený novorozenec má dostatečné zásoby železa na prvních 6 měsíců, poté je nutný přísun železa potravou. Nedonošené děti mají nižší koncentraci hemoglobinu a nižší zásoby železa, proto k depleci železa dochází již kolem 2. měsíce. Mateřské a kravské mléko mají stejný obsah železa, ale z kravského se hůře vstřebává. Obsah železa v mateřském mléce klesá po 5 měsících kojení. Chlapci potřebují v pubertě vyšší přísun železa díky nárůstu svalové hmoty a myoglobinu. Dívky potřebují vyšší přísun železa kvůli ztrátám při menstruačním krvácení.[1]
Klinický obraz a diagnostika
Mikrocytární hypochromní anémie. Distribuční šíře objemu erytrocytů (RDW) bývá zvýšená na podkladě anizocytózy. Relativně častá je trombocytóza (500-700×109/l).[1]
- Prelatentní sideropenie – deficit zásobního železa (snížená hladina ferritinu, ostatní hodnoty v normě).
- Latentní sideropenie – deficit zásobního a v makrofázích uloženého železa. To vede k deficitu železa v erytropoéze (snížená hladina ferritinu, železa a zvýšený solubilní transferrinový receptor sTFR), bez anémie.
- Sideropenická anémie – deficit zásobního i erytrocytárního železa má za následek pokles hladiny hemoglobinu, hematokritu, snížený střední objem erytrocytu (MCV), snížený obsah hemoglobinu v erytrocytu (MCH). Dále se projeví nízkou hladinou železa, ferritinu a zvýšením celkové vazebné kapacity stimulací produkce transferinu v játrech a zvýšení sTFR. Saturace transferrinu klesá pod 16 %, klesá hladina hepcidinu.[1]
V krvi je snížené množství retikulocytů, v kostní dřeni se vyskytuje více erytroblastů. Dřeň je normocelulární, při anemii ze zvýšených ztrát hypercelulární. Příznačné je vyčerpání zásobního železa (makrofágy nejeví hemosiderosu). Projevuje se především tkáňovou hypoxií (např. tygrovité srdce).
U dětí se projevuje nejčastěji mezi 6 měsíci a 3 roky života a poté v pubertě. Deficit železa v období růstu dítěte může vést ke zpomalení růstu, psychomotorického vývoje a poruch kognitivních funkcí (negativní vliv na učení soustředění). Poškození epitelu vede k atrofii papil jazyka a zvýšené lomivosti nehtů.[1]
Diferenciální diagnóza
- Anémie zánětlivých onemocnění – klasicky normocytární normochromní, u třetiny pacientů mikrocytární hypochromní, ale zvýšen ferritin a hepcidin.
- Thalasémie – mikrocytární hypochromní anémie, nižší RDW, v nátěru typické terčovité erytrocyty a bazofilní tečkování erytrocytů.
- Otrava olovem – mikrocytární/normocytární normochromní anémie; změny chování, křeče, renální poškození, bolesti břicha a zvracení.
- Sideroblastické anémie – hypochromní erytrocyty, zvýšená hladina železa v séru, zvýšená saturace transferrinu, věnečkovité sideroblasty v kostní dřeni („věnečky“ jsou mitochondrie přeplněné železem).[1]
Terapie a prevence
Prevencí je přidávání železa do kojenecké výživy, zavádění masozeleninových příkrmů, cereálie a mléčné přípravky obohacené o železo, vyloučení neadaptovaného kravského mléka z kojenecké stravy a profylaktické podávání železa u nedonošených dětí.
- Substituční přípravky
- Soli dvojmocného železa – síran železnatý (Aktiferrin, Ferronat);
- železo v komplexu s polysacharidy (Maltofer) – méně nežádoucích účinků;
- parenterální podávání trojmocného Fe – při prokázané malabsorpci, značných krevních ztrátách, noncompliance atd.. K úpravě anémie dochází stejně rychle jako při perorální substituci.
- Nežádoucí účinky
- Pocit plnosti, nauzea, zácpa či průjem. Akutní otrava železem se projeví závažnými gastrointestinálními příznaky, systémovou toxicitou. Jako antidotum používáme deferoxamin
 , který váže toxické volné železo.
, který váže toxické volné železo.
Efekt léčby se hodnotí vzestupem retikulocytů (4. – 10. den léčby), postupným vzestupem hemoglobinu (o 20 g/L za 4 týdny). Pro doplnění zásob železa je obvykle nutné pokračovat celkem 3–5 měsíců.[1]
Souhrnné video
Anémie z nedostatku kyseliny listové a vitaminu B12
- Anémie megaloblastické a makrocytární.
- Kyselina listová (resp. její aktivní forma – tetrahydrofolát (THF) je nezbytná pro syntézu DNA (a tedy i pro buněčné dělení)).
- Vitamin B12 se účastní přeměny methyl-THF na THF za současné tvorby methioninu (důležitý pro syntézu cholinu) z homocysteinu.
- Kyselina listová je obsažena především v zelenině, nedostatek se začíná projevovat po několika týdnech až měsících.
- Zdrojem vitaminu B12 je maso, mléčné a vaječné produkty, nedostatek vzniká až po několika letech.
- Nedostatek kyseliny listové postihuje:
- krvetvorbu – nedostatečná tvorba erytrocytů (megaloblastická a makrocytární anémie – převažuje), trombocytů i granulocytů;
- sliznici GIT – Hunterova glossitida, poruchy resorpce ve střevě, průjmy.
- Nedostatek vitaminu B12 postihuje:
- krvetvorbu a sliznici GIT – neboť vitamin B12 je nezbytný pro správnou funkci folátu, nedostatek vitaminu B12 lze v tomto ohledu zastoupit podáváním kyseliny listové.
- CNS – demyelinizace axonů, zvláště v míše (dáno nedostatkem methioninu, který je nutný pro syntézu cholinu, složky fosfolipidů myelinových pochev), na rozdíl od anémie, která odezní po obnovení dodávky vitaminu B12, mohou být neurologické projevy trvalé;
- homocysteinemie – může vést k trombozám.
Castleho antiperniciózní princip
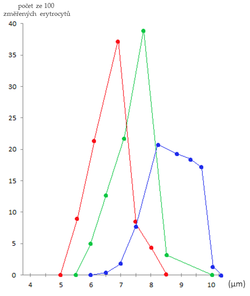
Červená = Hemolytická anémie (mikrocyty)
Zelená = norma
Modrá = Perniciózní anémie (makrocyty)
- Vnitřní faktor – glykoprotein produkovaný parietálními buňkami žaludeční sliznice.
- Zevní faktor – vitamin B12.
- Vitamin B12 se naváže na vnitřní faktor, vzniká tak komplex odolný proti natrávení a v ileu je resorbován enterocyty (mají specifické receptory) – příčinou nedostatku vitaminu B12 je nejčastěji nedostatek vnitřního faktoru (gastrektomie, protilátky proti vnitřnímu faktoru nebo parietálním buňkám žaludeční sliznice – gastritis A – chronická atrofická gastritis, postihuje tělo a antrum žaludku) nebo onemocnění ilea (resekce, záněty, malabsorpce, nadměrná spotřeba vitaminu B12 pomnoženými střevními bakteriemi – např. v pahýlu střeva po gastrektomii), infekce tasemnicí Diphyllobothrium latum.
- Nedostatek vitaminu B12 vznikající nedostatečným příjmem vitaminu B12 potravou je nejčastěji publikovaným problémem stravy veganů (zdrojem vitaminu B12 je maso, vejce a mléčné výrobky – tyto potraviny vegani nekonzumují).[2] Megaloblastová anémie z nedostatečného příjmu vitaminu B12 potravou je velmi častá v rozvojových zemích, jejichž obyvatelé nemají peníze, a tudíž přístup k potravinám živočišného původu (stávají se „nechtěnými vegany“).
- Anémie vznikající v důsledku autoimunitního procesu namířeného proti parietálním buňkám žaludeční sliznice se označuje jako perniciózní anémie. Autoprotilátky destruují parietální buňky, žaludeční sliznice atrofuje, vzniká achlorhydrie. To vše vede ke snížení produkce vnitřního faktoru, který je nezbytný pro vstřebávání vitaminu B12 v ileu. Kromě autoprotilátek proti pariteální buňkám jsou produkovány také autoprotilátky, které brání vazbě vitaminu B12 na vnitřní faktor nebo brání vazbě komplexu vitamin B12–vnitřní faktor na receptor zajišťující vstřebání tohoto komplexu v ileu.[3][4]
- K anémii z nedostatku kyseliny listové vede podávání některých léků (např. cytostatika metotrexátu – inhibuje její přeměnu v THF).
- Kostní dřeň bývá hypercelulární.
- Buňky dřeně i v periferní krvi jsou zvětšené (prodloužené vyzrávání jejich prekurzorů – makrocyty, megaloblasty (velké erytroblasty s nezralým vzhledem jádra)).
- Hemoglobinu je ve zvětšených erytrocytech více (hyperchromní anémie).
- Velké erytrocyty zanikají často přímo ve dřeni, aniž by se vůbec dostávaly do oběhu (neefektivní erytropoesa) – hemolýza.
- Jsou také zvýšeně destruovány makrofágy RES.
- V krevním obrazu je kromě přítomnosti makrocytů důležitý malý obsah retikulocytů a hypersegmentace jader granulocytů.
Odkazy
Související články
Zdroj
- PASTOR, Jan. Langenbeck's medical web page [online]. [cit. 12.4.2010]. <https://langenbeck.webs.com/>.
Reference
- ↑ a b c d e f g h LEBL, J, J JANDA a P POHUNEK, et al. Klinická pediatrie. 1. vydání. Galén, 2012. 698 s. s. 538-540. ISBN 978-80-7262-772-1.
- ↑ NEČAS, Emanuel, et al. Patologická fyziologie orgánových systémů : Část I. 1. vydání. Praha : Karolinum, 2007. ISBN 978-80-246-0675-0.
- ↑ ČEŠKA, Richard, et al. Interna. 1. vydání. Praha : Triton, 2010. 855 s. ISBN 978-80-7387-423-0.
- ↑ JIRÁSEK, Václav, Marie BRODANOVÁ a Zdeněk MAREČEK. Gastroenterologie, Hepatologie. 1. vydání. Praha : Galén, 2002. ISBN 80-7262-139-4.




