Biosyntéza nukleových kyselin
(přesměrováno z Biosyntéza NK)
Nové polynukleotidy jsou v buňce syntézovány z mononukleotidů, při čemž původní (matricový) řetězec pomáhá řadit nukleotidy vznikajícího řetězce na základě zákonitého párování bazí. Syntéza molekuly DNA podle matrice (předlohy) DNA nebo syntéza RNA podle matrice RNA se nazývá replikace, syntéza RNA na matrici DNA je považována za přepis, čili transkripci a při syntéze DNA podle matrice RNA se jedná o reverzní (zpětnou) transkripci. Při translaci (překladu) se syntézuje peptid, a to na základě informace uložené v sekvenci nukleotidů RNA. Nově vzniklé nukleové kyseliny mají stejný informační obsah jako jejich matrice; nový řetězec není s předlohou identický, nýbrž komplementární a má opačnou polaritu.
Replikace DNA[upravit | editovat zdroj]
Pojem replikace zahrnuje nejen prodlužování (elongaci) řetězce, nýbrž také zahájení (iniciaci) a ukončení (terminaci) této syntézy.
Biosyntéza DNA v baktériích[upravit | editovat zdroj]
Baktérie mají řadu předpokladů k tomu, aby procesy uchovávání a exprese genetické informace byly podrobněji poznány právě u nich. Rychle se dělí a mechanismy dědičnosti jsou jednodušší než v jaderných buňkách. Základní principy těchto dějů jsou však shodné v obou systémech. K experimentům nejčastěji posloužila baktérie Escherichia coli. Meselson a Stahl prokázali, že replikace DNA je semikonzervativní. To znamená, že každý ze dvou řetězců dvoušroubovice je matricí pro syntézu řetězce nového. Výsledkem jsou dvě dvoušroubovice, z nichž každá je hybridem jednoho původního a jednoho nového řetězce DNA.
Enzymy, které katalyzují prodlužování syntézovaného řetězce, se nazývají DNA-závislé (dependentní) DNA-polymerázy. Experimenty in vitro ukázaly, že k elongaci DNA je kromě enzymu třeba matricová DNA, současně všechny čtyři deoxynukleosidtrifosfáty (dATP, dGTP, dTTP, dCTP), ionty Mg2+ a tzv. očko, primer, což je kratší řetězec nukleové kyseliny (DNA nebo RNA) s volným 3'-OH koncem. DNA-polymerázy totiž nejsou schopny zahájit syntézu řetězce od samotného mononukleotidu, de novo.
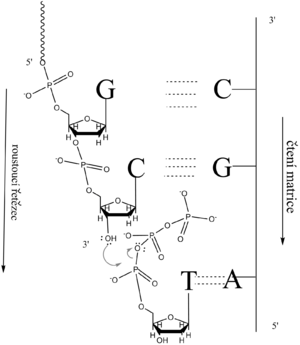
Primer je hybridizován na matricový řetězec. Podle první nepárované baze matricového řetězce, nacházející se u 3'-konce primeru, je vybrán komplementární dNTP. Jeho α-fosfát je atakován nukleofilním kyslíkem koncové 3'-OH primeru (nebo rostoucího řetězce DNA). Přesunem elektronů se uvolní β- a γ-fosfát jako pyrofosfát (PPi), zatímco α-fosfát deoxynukleotidu je vázán na 3'-OH skupinu primeru (nového řetězce DNA). Potud se jedná o vratnou reakci. Makroergický PPi se však pohotově štěpí pyrofosfatázou, což posunuje rovnováhu směrem k syntéze řetězce.
Z uvedeného mechanismu vyplývá, že syntézovaný polynukleotid roste směrem 5' → 3', zatímco matricový řetězec je čten směrem 3' → 5'.
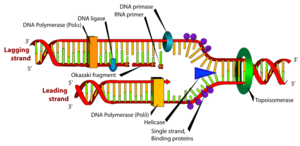
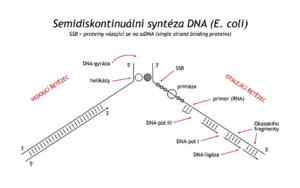
Když se zjistilo, že syntéza DNA postupuje současně po obou antiparalelních mateřských řetězcích, které se při tom rozplétají (replikační vidlice), bylo třeba objasnit, jak příroda vyřešila syntézu DNA na řetězcích opačné polarity a jak je zajištěno rozplétání vyšších struktur DNA. První z problémů se objasnil, když se ukázalo, že syntéza DNA je semidiskontinuální (viz obr.). Tzv. vedoucí řetězec (leading strand) roste, jak již bylo uvedeno, nepřetržitě a směrem 5' → 3', zatímco syntéza na antiparalelní matrici je složitější. Matrice je vhodně stočená a ve směru 5' → 3' na ní vzniká opožďující se řetězec (lagging strand), a to ve formě kratších úseků, Okazakiho fragmentů. Fragmenty jsou pak dodatečně spojeny v kontinuální řetězec. K zahájení syntézy každého fragmnentu je třeba primer. Je syntézován zvláštní RNA-polymerázou zvanou primáza. Výběr místa pro syntézu primeru není náhodný. Primáza je součástí proteinového komplexu primozomu, stejně jako N protein, poznávající vhodnou sekvenci v místě budoucího primeru (průměrná vzdálenost těchto míst je 1000–2000 bp). Na rozdíl od DNA-polymeráz, primáza je schopna zahájit syntézu řetězce od jediného nukleotidu. Vytvoří RNA kratší než 10 nukleotidů. Od 3'-OH konce tohoto primeru DNA-dependentní DNA-polymeráza III nasyntézuje Okazakiho fragment dlouhý 1000–2000 nukleotidů, než dospěje k předchozímu primeru. Pak je nahrazena DNA-polymerázou I, která vedle polymerázové aktivity má též 5' → 3' exonuklázovou aktivitu. Enzym zruší předchozí primer a prodlouží DNA fragment k začátku předchozího fragmentu DNA.
Rozdílná schopnost RNA- a DNA-polymeráz zahájit de novo syntézu řetězce souvisí s tím, že DNA-polymerázy kontrolují a případně korigují párování posledního nukleotidu v řetězci, než ho prodlouží o další nukleotid. Přesnost DNA-polymeráz je řádově vyšší ve srovnání s přesností RNA-polymeráz. RNA představuje asi starší a méně přesnou formu ukládání a přenosu genetické informace než DNA.
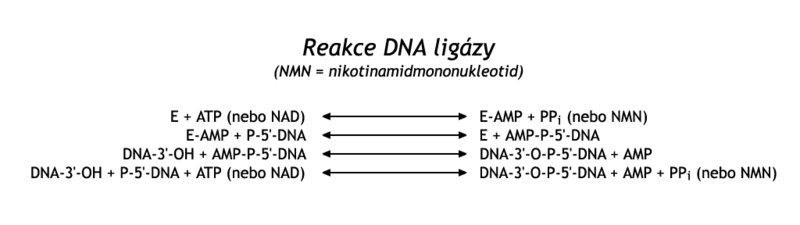
V popsaném procesu na opožďujícím se řetězci zbývá spojit Okazakiho fragmenty v kontinuální DNA. Tuto reakci katalyzuje DNA-ligáza. Enzym spojuje fosfodiesterovou vazbou 3'-OH konec jednoho řetězce DNA s 5'-fosfátovým koncem jiného řetězce. DNA-ligáza se nejprve aktivuje tím, že na ε-NH2 skupinu svého lysinu přijme AMP, pocházející z ATP nebo z NAD. Tento komplex se přechodně naváže na 5'-fosfát na konci napojované DNA, a tím ho aktivuje. Pak se na tento fosfát nukleofilní atakou napojí skupina 3'-OH druhého fragmentu. Současně se uvolní AMP (viz reakční schema).
DNA ligáza má řadu funkcí. Kromě Okazakiho fragmentů napojuje řetězce DNA při jejích reparacích, při „crossing over“, a používá se též při umělých genových manipulacích.
Kromě DNA-polymeráz, primozomu a DNA-ligázy se v replikační vidlici uplatňují další proteiny. Za současného štěpení ATP dvoušroubovici rozplétá enzym helikáza. Na uvolněné řetězce se ihned navazují SSB-proteiny (single strand binding proteins), tedy proteiny navazující se na jednořetězcovou DNA, aby zabránily její reasociaci v místě replikace.
Komplex enzymů v replikační vidlici se někdy nazývá replisom. Při postupu replisomu a rozplétání pravotočivé dvoušroubovice musí původní DNA rotovat kolem své osy proti směru hodinových ručiček, čímž by vznikalo pnutí a kladná nadšroubovice. Replikace by se zastavila. Problém řeší topoizomerázy; DNA gyráza může zavést negativní nadšroubovici, swiveláza ji ruší. Oba enzymy udržují určitou míru negativního supersvinutí DNA, podporujícíhho rozvinování helixu dsDNA
Iniciace replikace DNA v bakteriích[upravit | editovat zdroj]
Zahájení (iniciace) replikace bakteriální DNA je velmi přesně řízený proces. Na cirkulární dsDNA (asi 4 miliony bp) existuje jediné místo (ori C) se čtyřmi opakujícími se sekvencemi devíti párů bazí (bp). Jsou rozmístěny v úseku DNA dlouhém 240 bp. Navazují se na ně replikační proteiny dnaA (název je odvozen od genu, na kterém vznikají). DNA se zákonitě svine a na komplex se připojí další proteiny dnaB a dnaC. Protein dnaB má helikázovou aktivitu, částečné rozvine dvoušroubovici, navážou se SSB proteiny a další helikázy a syntézou primeru je zahájena replikace.
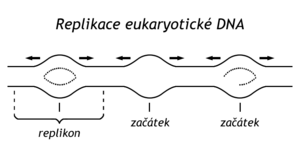
U bakterií a virů se obvykle vytvoří v místě ori dvě replikační vidlice, které pak po DNA postupují od sebe opačným směrem, čímž vytvoří tzv. replikační oko (obr.).
Terminace replikace u bakterií[upravit | editovat zdroj]
U cirkulárních DNA baktérií a virů se replikace ukončuje setkáním replizomů na protilehlé straně cirkulární DNA. Úsek od místa ori k místu ukončení replikace se nazývá replikon. U bakterií se jedná o cirkulární replikon. Nové cirkulární molekuly DNA však mohou být provlečené (obr 1-14). Rozpojit je dokáže topoisomeráza typu II.
V případě lineárních molekul DNA (některé virové DNA) je k terminaci replikace nutný mechanismus, který řeší nedokončenou syntézu DNA na 5'-konci nového řetězce (úsek po odstranění primeru). Problém je řešen několika způsoby, např. vhodnými koncovými sekvencemi a stočením replikované DNA, nebo zahájením syntézy z obou konců matricové dsDNA.
Multiplicita DNA-polymeráz a reparace poškozené DNA u bakterií[upravit | editovat zdroj]
V E. coli byly rozpoznány tři DNA-závislé DNA-polymerázy:
| Typ enzymu | I | II | III |
|---|---|---|---|
| Polymerace 5' → 3' | + | + | + |
| Nukleázová aktivita 3' → 5' | + | + | + |
| Nukleázová aktivita 5' → 3' | + | − | + |
| Počet molekul v buňce | 400 | ? | 10–20 |
| Rychlost elongace (počet nukleotidů / min) | 600 | ? | 10 000 |
| Počet podjednotek | 1 | ? | 7 |
| Molekulová hmotnost | 109 000 | 120 000 | 250 000 |
DNA-polymeráza I byla objevena první, neboť je jí v buňce nejvíce. Je sice tvořena jediným peptidovým řetězcem o molekulové hmotnosti 109 000, oplývá však třemi enzymovými aktivitami, polymerázovou a dvěma nukleázovými. Ke 3' → 5' exonukleázové aktivitě je třeba, aby 3'-OH skupina nebyla esterifikována a odštěpovaný nukleotid musí být volný, nespárovaný. Aktivita slouží k úpravě chybného konce primeru nebo k odstranění chybně zařazeného nukleotidu. 5' → 3' nukleasové místo je odděleno od polymerasového centra. Odštěpuje koncový mono- nebo oligonukleotid na 5'-konci řetězce (fosforylovaném či volném), přičemž odštěpovaný nukleotid musí být spárován s komplementární bazí v dsDNA. Ukázalo se, že DNA-polymeráza I není vlastním replikačním enzymem E. coli, nýbrž enzymem reparačním. Struktura DNA není tak stálá, aby mohla zajistit známou funkční stabilitu genů v čase. Spontánně, termálními pohyby se často zruší β-glykosidové vazby purinových bazí, cytosin se deaminuje na uracil, vlivem ultrafialového světla se kovalentně svážou dva sousední thyminy (TT dimery). DNA-polymeráza I rozpozná chybný nukleotid, úsek, ve kterém se nachází, enzym vyštěpí a podle komplementárního řetězce nasyntézuje správný řetězec („záplatu“). 3'-OH konec opraveného úseku DNA ligáza naváže na původní řetězec.
Mutanta E. coli s defektem DNA-polymerázy I je výrazně citlivější k působení mutagenů, dělí se však stejnou frekvencí jako normální bakterie. Z toho vyplývá, že vlastním replikačním enzymem je jiná polymeráza. Ukázalo se, že tuto funkci má DNA-závislá DNA-polymeráza III. Bakterie sice obsahuje jen 20 molekul enzymu, ten však prodlužuje řetězec patnáctkrát rychleji než typ I. Holoenzym DNA-polymerázy III se skládá nejméně ze 7 podjednotek α, β, γ, δ, θ, ε, τ. Kromě polymerázové aktivity (podj. α) má též 3' → 5' a 5' → 3' nukleázovou aktivitu. Funkce dalšího enzymu, DNA-polymerázy II zatím není známa.
Replikace chromozomové DNA v eukaryotech[upravit | editovat zdroj]
V této kapitole budou popsány nejdůležitější odlišnosti replikace v jaderných buňkách od replikace bakteriální DNA. V eukaryotických buňkách jsou čtyři DNA-závislé DNA-polymerázy (viz tab.), které mají stejné základní rysy polymerázové aktivity jako bakteriální enzymy: prodlužují řetězec DNA na 3'-konci, substrátem jsou dNTP, k replikaci je třeba matrice a primer. Hlavními replikačními enzymy eukaryot jsou DNA-polymerasy α a δ, každá na jednom parentálním řetězci, zatímco DNA-polymeráza β má reparační funkci. Enzym γ replikuje mitochondriální DNA.
| Typ enzymu | α | β | γ | δ |
|---|---|---|---|---|
| Polymerace 5' → 3' | + | + | + | + |
| Nukleázová aktivita 3' → 5' | − | − | + | + |
| Relativní aktivita | 80 % | 10–15 % | 2–15 % | ? |
| Počet podjednotek | několik | 1 | 1 | ? |
| Lokalizace | jádro | jádro | mitochondrie | jádro |
| Molekulová hmotnost | 140 000 | 40 000 | 150 000 | ? |
| Funkce | replikace | opravy | replikace mtDNA | replikace |
Na dlouhé molekule eukaryotické DNA začíná replikace na mnoha místech současně. Vytvoří se řada replikačníích ok, desítky tisíc na DNA embryí, tisíce na molekule DNA dospělých živočichů.
Rychlost replikační vidlice je u eukaryot 4× pomalejší než u bakterií, takže např. nejdelší chromozom Drosophily by se z jednoho místa replikoval 16 dní, ve skutečnosti to trvá 3 minuty.
Okazakiho fragmenty v jaderných buňkách jsou tvořeny jen asi 140 nukleotidy.
Reparace chromozomální DNA je stejně nezbytná, jako u bakterií. DNA v každé lidské buňce denně ztratí 5000 purinových bazí (ternální přerušení β-glykosidové vazby), 100 cytosinů v DNA se spontánně deaminuje na uracil a ultrafialové světlo vytváří ze sousedních thyminů kovalentní dimery. Reparační mechanismy musí vysokou frekvenci v zavádění genetických chyb snížit na minimum. Pacienti s kožní chorobou xeroderma pigmentosum (autosomální recesivní znak) mají defektní nukleázu, která hydrolyzuje DNA poblíž thyminových dimerů. Choroba se projevuje přecitlivělostí kůže na sluneční záření, suchostí a atrofií kůže, keratózou, vředy rohovky a zpravidla do 30. roku života se vyvine karcinom kůže.
S opravami genomu souvisí též přítomnost thyminu v DNA a uracilu v RNA. Deaminace cytosinu na uracil je potenciálně mutagenní změna. Enzym uracil-DNA-glykosidáza hydrolyzuje glykosidovou vazbu mezi uracilem a deoxyribózou. Místo bez baze pozná specifická endonukleáza. Po naštěpení řetězce reparační DNA-polymeráza a DNA-ligáza opět vestaví správný úsek s cytosinem. Kdyby byl v DNA místo thyminu uracil, žádný enzym by nerozlišil "správný" uracil od deaminovaného cytosinu. Energie vynaložená na metylaci uracilu na thymin je "daň" za přesnost v uchovávání genetické informace. Deaminace cytosinu v RNA není tak kritická. Určitá molekula DNA bývá v buňce pouze v jedné nebo několika kopiích, záměna baze v DNA je tedy mnohem závažnější, než záměna baze v jedné z obrovského množství stejných molekul RNA.
Mechanismus reparací též vysvětluje, jak důležité je dvouřetězové uspořádání molekul DNA.
Osud histonů při replikaci DNA[upravit | editovat zdroj]
Histony jsou syntetizovány hlavně během S-fáze buněčného cyklu. Z cytoplazmy pak vstupují do jádra, kde se navazují na DNA. Malá část histonů je asi syntetizována v průběhu buněčného cyklu a je snad určena k reparacím.
Experimenty s izotopově značenými aminokyselinami ukázaly, že nově syntetizované histony vytvoří kompletní nové oktamery; nebyly nalezeny smíšené komplexy, které by obsahovaly staré i nové histony. Nové oktamery se navazují k nově syntetizované DNA, nevyměňují se s histony v nereplikující se části DNA. Zatímco původní histony byly po replikaci nalezeny na dvoušroubovici s vedoucím řetězcem DNA, nové oktamery se navazují na DNA s opožďujícím se řetězcem.
Transkripce[upravit | editovat zdroj]
Transkripcí označujeme syntézu RNA podle matrice DNA. Proto se enzymy katalyzující tuto reakci nazývají DNA-závislé (dependentní) RNA-polymerázy. Nevyžadují primér, syntézu začnou na 1’-OH nukleotidu GTP nebo ATP. Stavebními jednotkami jsou v tomto případě ribonukleosidtrifosfáty (ATP, GTP, UTP, CTP). Mechanismus prodlužování řetězce je stejný jako při syntéze DNA. Při transkripci tedy RNA roste směrem 5' → 3' a matrice DNA je čtena směrem 3' → 5'. Přepisovanému úseku DNA se říká skripton, nově syntetizovaná RNA je transkript. Ten je pak několika typy reakcí upravován ve funkční RNA. Na rozdíl od replikace je transkripce asymetrická; v daném úseku je přepisován pouze jeden řetězec DNA (negativní neboli antikódující). Z hlediska transkripce je pak druhý řetězec DNA (se stejným pořadím nukleotidů jako v syntézované RNA) označován jako pozitivní, kódující. Na téže molekule DNA, ale v jiném úseku, se ovšem může přepisovat opačný řetězec. Transkripcí vzniká několik typů RNA, které se funkčně dají rozdělit do tří skupin: ribosomální RNA (rRNA) je strukturní součástí podjednotek ribozomů, transferové RNA (tRNA) přenášejí aktivované aminokyseliny na místo syntézy polypeptidu a messengerové RNA (mRNA, informační RNA, mediátorové RNA, messenger = poslíček), které přenášejí informaci o pořadí aminokyselin v peptidu od DNA k místu proteosyntézy na ribosomu.
Transkripce v baktériích (E.coli)[upravit | editovat zdroj]
V bakterii E.coli jsou syntetizovány různé typy RNA. Syntézu všech typů RNA katalyzuje jediný enzym, DNA-závislá RNA-polymeráza, tvořená pěti podjednotkami: 2α, β, β’, σ. Podjednotka α váže β a β’ podjednotky a je významná pro rozpoznání počáteční sekvence skriptonu. Podjednotka β má aktivní místo pro tvorbu fosfodiesterové vazby, β se účastní vazby polymerázy s DNA. Podjednotka σ (též σ-faktor) je nutná k rozpoznání začátku skriptonu (tzv. promotoru).
Zahájení (iniciace) bakteriální transkripce[upravit | editovat zdroj]
Transkripce je zahajována v úseku DNA, nazývaném promotor. Sekvence nukleotidu v bakteriálních promotorech je u různých transkripčních jednotek analogická. První přepisovaný nukleotid je číslován +1. V okolí 10. nukleotidu proti směru transkripce se nachází tzv. Pribnowův box, což je sekvence, která se příliš neliší od sekvence 5' TATAAT 3'. Čím více se Pribnowův box blíží této sekvenci, tím častěji je promotor rozpoznáván RNA-polymerázou a tím častěji je zde zahajována transkripce ("silný" promotor). Kolem 35. nukleotidu bývá další obecná sekvence, převážně 5' TTGACA 3',která přispívá též k síle promotoru.
RNA-polymeráza se náhodně a slabě navazuje na kterékoli místo na DNA, v krátkém úseku se pohybuje po matrici a zase se uvolní. V případě, že tímto způsobem najde promotor, naváže se pevněji. Ke specifitě vazby na promotor přispívá s-faktor. Polymeráza rozvine krátký úsek dvoušroubovice DNA (asi 17 pb) a u +1 nukleotidu zahájí transkripci. RNA-polymerázy na rozdíl od ONA-polymerázy nevyžadují oligo- nebo polynukleotidový primer (očko), syntézu nového řetězce zahajují buď od adenosintrifosfátu nebo guanosintrifosfátu.
Elongace syntézovaného řetězce RNA[upravit | editovat zdroj]
Po navázání několika prvních nukleotidů nového řetězce RNA se z polymerázy uvolní σ-faktor, polymeráza postupuje po matrici (antikódující řetězec DNA) a syntézuje RNA (transkript). Asi 10–12 nukleotidů nově syntézované RNA zůstává navázáno (hybridizováno) v místě transkripce, prodlužovaný řetězec RNA se za tímto úsekem uvolňuje, odvíjí. Přepsaný úsek DNA se opět svinuje do dvoušroubovice. RNA-polymerázy na rozdíl od DNA-polymeráz nemají nukleázovou aktivitu, nekorigují nesprávně zařazené nukleotidy. Transkripce není tak přesná jako replikace (syntéza DNA).
Ukončení, terminace transkripce u baktérií[upravit | editovat zdroj]
Polymeráza postupuje až do úseku DNA, nazývaného terminátor. Sekvenčně jde o obrácenou repetici bohatou na G a C, která je přerušena jedinečnou sekvencí. Transkript terminátoru vytvoří vlásenku se smyčkou. Následuje oligosekvence 4-8 dA, přepisovaná do odpovídajícího oligo-U úseku transkriptu. Hybrid DNA-RNA je v úseku s opakujícími se A=U páry labilnější, než hybrid RNA-RNA ve vlásence s častými páry G=C. Proto se transkript uvolní. Na tomto terminátoru je transkripce ukončena vždy, proto se nazývá obligátní terminátor. Před obligátním terminátorem bývají tzv. fakultativní terminátory. Neobsahují oligosekvenci d AAAA.., k ukončení transkripce je zde třeba regulační protein, ρ-faktor (rhó), který se naváže na vlásenku RNA a pomůže uvolnit transkript. Po zastavení RNA-polymerázy, uvolnění hotové RNA a uvolnění polymerázy od DNA se matricová DNA opět zcela zavine do dvoušroubovice. Skripton je regulován jako transkripční celek, v tomto smyslu je u baktérií nazýván operonem. Pro bakteriální operon je charakteristické, že tandemově uspořádané geny se přepisují do jediného velkého transkriptu. V případě strukturních genů (kódujících polypeptidy) je transkriptem tzv. polycistronická (multigenní) mRNA. Ribozomy pak na tomto tandemu informací syntézují jednotlivé peptidy. Na rozdíl od baktérií v jaderných buňkách neexistuje mechanismus, který by tyto informace oddělil, a tak u eukaryot se často funkční peptidy oddělují až v rámci posttranslačních úprav velkého proteinového prekurzoru. Z jednoho velkého proteinu např. vzniká několik peptidových hormonů.
Inhibitory bakteriální transkripce[upravit | editovat zdroj]
Některé látky interferují s určiton fází transkripce a tak ji inhibují. Antibiotikum rifampicin se váže na β-podjednotku RNA-polymerázy; enzym se sice může navázat na DNA, ale nezahájí přepis. Streptolygidin vazbou na 13-podjednotku polymerázy zastaví elongaci transkriptu. V experimentech se často používá antibiotikum aktinomycin D. lnhibuje nejen bakteriální, ale i eukaryotickou transkripci; jeho fenaxozonový kruh interkaluje (vsune se) mezi báze DNA a každý z jeho peptidových řetězců vytvoří silný vodíkový můstek s -NH guaninu. Polymeráza se u antibiotika zastaví. Kyselý glykosaminoglykan heparin se navazuje na silně bazickou β’-podjednotku RNA-polymerázy a brání v navázání polymerázy na DNA.
Posttranskripční úpravy (zrání, processing) bakteriálních RNA[upravit | editovat zdroj]
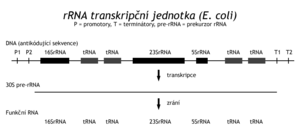
Nově syntézované RNA jsou upravovány ve funkční molekuly. U prokaryot tomuto zrání podléhají pouze tzv. "stálé" RNA, t.j. rRNA a tRNA, zatímco mRNA s několikaminutovým poločasem své existence se syntézují ve funkční formě. Ještě v průběhu transkripce na nedokončenou mRNA se v baktériích navazují ribozomy, translace probíhá současně s transkripcí stejně jako degradace mRNA za posledním ribozomem. V jaderných buňkách jsou transkripce a translace časově a prostorově odděleny, mRNA zde mezitím podléhá komplikovaným zracím procesům. Transkripty stálých bakteriálních RNA obsahují několik funkčních molekul RNA, které jsou z těchto prekurzorů vyjmuty účinkem specifických exo- a endonukleáz. V E. coli je jich asi 10 druhů, několik z nich je uvedeno v tabulce:
| Nukleázy podílející se v E.coli na posttraskripčních úpravách RNA | ||
|---|---|---|
| Enzym | Štěpí | Specifita |
| RNáza P | tRNA 5’-konec | endo- |
| RNáza D | tRNA 3’-konec | exo- |
| RNáza T | tRNA CCA | exo- |
| RNáza III | rRNA (a mRNA fágů) | endo- |
| RNáza H | RNA-DNA hybrid | endo- |
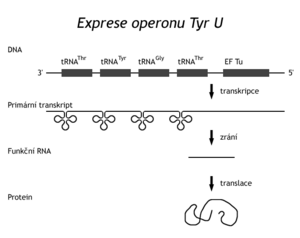
Tyto nukleázy rozpoznávají místo působení podle konformace substrátu, nikoli podle sekvence štěpené nukleové kyseliny. Geny pro rRNA jsou umístěny ve shluku s geny několika tRNA. Transkripcí operonu vznikne 30S prekurzor rRNA, který pak RNáza III rozštěpí na úseky, obsahující funkční molekuly. Další enzymy pak upraví tyto RNA do konečné funkční formy. Také další transferové RNA jsou syntézovány ve shlucích. V genomu "E.coli" je tzv. TyrU-operon, obsahující geny pro dvě různé tRNAThr, tRNATyr, tRNAGly a gen pro elongační faktor potřebný při translaci. V jiném operonu TyrT jsou dva stejné geny pro tRNATyr a gen pro protamin (protein P). Ostatní tRNA jsou transkribovány z monogenních transkripčních jednotek. Transkripcí TyrU-operonu vznikne prekurzor RNA, který je nejdříve rozštěpen RNázou P (endonukleáza), a to v místech definitivních 5' konců tRNA. RNáza P kromě peptidového řetězce obsahuje též RNA (375 bazí). Pak asi následují exonukleázové úpravy 3'-konců tRNA. RNáza D je štěpí až k CCA sekvenci, 3'-konec pozná podle konformace. Transkript totiž nemusí sekvenci CCA obsahovat, pokud není kódován v genu. U baktérií totiž rozlišujeme 2 typy tRNA. Typ 1 obsahuje 3'-koncovou sekvenci CCA v genu, typ II nikoli. Ve druhém případě se sekvence -CCA neho její chybějící část posttranskripčně doplňuje účinkem tRNA nukleotidyltransferázy. Jde o další typ zracího (a reparačního) mechanismu. Konečný adenosin se totiž často od zralé tRNA uvolňuje.
Transkripce v živočišných buňkách[upravit | editovat zdroj]
V jaderných buňkách se syntetizují analogické typy RNA jako v baktériích. V eukaryotech se navíc nachází jedna malá rRNA (5SrRNA), heterogenní RNA, která obsahuje prekurzory pro mRNA (pre-mRNA), malé jaderné (snRNA) a jadérkové RNA (snoRNA) a mitochondriální RNA (mtRNA). Kromě mitochondriální RNA transkripty vznikají v jádře a pak, většinou ve formě ribonukleoproteinu, podléhají úpravám a případně se přemísťují do cytoplazmy. Syntézu RNA v eukaryotech katalyzují čtyři typy DNA-závislých RNA-polymeráz (viz tabulka). Každá z nich je sestavena z 10−15 podjednotek (protomérů).
| Základní typy eukaryotických RNA | ||||
|---|---|---|---|---|
| Prekurzory | Funkční typ | Molekulová hmotnost | Lokalizace v buňce | Zastoupení (%) |
| 45S pre-rRNA | 4,5x106 | jadérko | 1 | |
| 35S | ||||
| 28S | 5,8S rRNA | rib.podj. 60S | ||
| 28S rRNA | 1,7x106 | 53 | ||
| 23S | 18S rRNA | 0,7x106 | rib.podj. 40S | 24 |
| 5S rRNA | 4,2x104 | rib.podj. 60S | 1 | |
| pre-tRNA | 4S tRNA | 2,3–3x104 | cytoplazma | 12 |
| hn-RNA | ||||
| pre-mRNA | 6–30S mRNA | 3x104 (2x10 cytoplazma) | polysomy | 3 |
| snRNA | ||||
| snoRNA | ||||
| mtRNA | mitochondrie | |||
| Typy eukaryotických RNA-polymeráz | |||
|---|---|---|---|
| RNA-polymeráza | Lokalizace | Citlivost k inhibitorům | Produkt |
| I | jadérko | rezist. na α-amanitin | 45S rRNA |
| II | jádro | velmi sensit. na α-amanitin | hnRNA, (pre-mRNA), snRNA |
| III | jádro | středně sensitivní na α-amanitin | tRNA, 5S rRNA, snRNA |
| mitochondr. | mitochondrie | sensitivní na rifampicin | mtRNA |
Každá RNA-polymeráza má charakteristický typ promotoru. Nejlépe je zatím poznán promotor polymerázy II. Jeho struktura je analogická s prokaryotickým promotorem.
Iniciace eukaryotické transkripce[upravit | editovat zdroj]
Dlouhá molekula DNA v chromozomu je složitě svinuta a vázána s proteiny. Úsek, který má být přepsán, musí být zpřístupněn. Mechanismy rozvinování DNA se studují. Několik regulačních proteinů potlačí aktivitu deacelylázy, takže acetylace histonů acetyltransferázou převládne. Nukleozomový řetězec se přechodně rozvine, po lokální ztrátě nukleozomových histonů se DNA převede do nadšroubovicové konformace. Energie této konformace je využita k regionálnímu rozpletení šroubovice DNA, což umožní zahájit transkripci. Po defosforylaci regulačních proteinů nabude převahy opět deacetylace, umožňující obnovu histonových oktamérů, nukleozomů a zavinutí DNA. V 5S rRNA genu se promotor pro RNA-polymerázu III nachází až za +1 nukleotidem v genu. K navázání polymerázy je zřejmě nutný faktor, který se navazuje na pozitivní řetězec DNA a umožní vazbu polymerázy na místo pro správné zahájení transkripce negativního řetězce DNA. Prodlužování živočišných RNA probíhá mechanismem popsaným u baktérií. Terminace u eukaryot není zatím podrobně prostudována.
Inhibitory eukaryotické transkripce[upravit | editovat zdroj]
Aktinomycin D inhibuje transkripci v jaderné buňce stejně jako v baktérii. Dalším dokladem pro endosymbiotickou teorii vzniku mitochondrií je analogie v citlivosti mitochondriální RNA-polymerázy a bakteriální RNA-polymerázy k inhibitorům (např. k rifampicinu). α-amanitin je peptid produkovaný některými vyššími houbami, především vyspce jedovatou muchomůrkou zelenou (Amacita phalloides). Toxin se váže na RNA-polymerázu II a zastavuje přednostně syntézu mRNA. Nejvíce bývají postiženy jaterní buňky.
Posttranskripční úpravy (processing, zrání) eukaryotických RNA[upravit | editovat zdroj]
Úpravy rRNA[upravit | editovat zdroj]
Ukázalo se, že u eukaryot jsou posttranskripčně upravovány všechny tři hlavní typy RNA (rRNA, tRNA i mRNA). Tři z funkčních rRNA, t.j. 18S rRNA, 5.8S rRNA a 28S rRNA jsou obsaženy v primárním transkriptu 45S pre-rRNA. 45S pre-rRNA je metabolicky stabilnější než prokaryotický transkript 30S pre-rRNA. Je enzymově štěpen a modifikován ve tři funkční rRNA. Asi 100 nukleotidů je metylováno na 2'-OH a více než 100 uridinů je izomerováno na pseudouridin. Na rozdíl od prokaryot gen pro rRNA neobsahuje geny pro tRNA. Eukaryotické buňky syntézují ještě další ribozomální RNA – 5S rRNA, a to na opakujícím se genu, provázeném vždy nefunkčním pseudogenem. Tato molekula se asi posttranskripčně neupravuje.
Úpravy tRNA[upravit | editovat zdroj]
V eukaryotických buňkách je několik set až tisíc genů pro tRNA. Geny pro určitou tRNA se tedy mnohokrát opakují, jde o repetice rozptýlené po celém genomu. Primární transkript je zkracován koncovými úpravami. U eukaryot je znám též sestřih tRNA (splicing), což je vyštěpení určitého vnitřního úseku (intronu) pre-RNA. lntrony eukaryotických pre-tRNA neobsahují charakteristické okrajové sekvence. Místa štěpení jsou poznána specifickou endonukleázou na základě terciální struktury pre-tRNA. Oba vzniklé fragmenty napojuje RNA-ligáza za štěpení ATP. Značně odlišné mechanismy sestřihu byly objeveny u eukaryotických pre-mRNA.
Úpravy mRNA[upravit | editovat zdroj]
Transkripcí strukturního genu vzniká pre-mRNA (jejich směs je někdy označována jako heterogenní nukleární RNA, hnRNA). Na tento primární transkript se navazují proteiny. Je při tom podroben čtyřem typům posttranskripčních úprav:
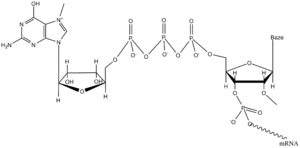
Připojení čapky (angl. capping). Také u eukaryot transkripce začíná na ATP nebo GTP. První úpravou vznikající pre-mRNA je připojení 7-methylguaninového nukleotidu k 5'-trifosfátovému konci ještě nedokončeného řetězce. Nejdříve se z něho odštěpí jeden fosfát a difosfátový konec pak atakuje α-fosfor volného GTP. Vznikne tím neobvyklá 5'–5' anhydridová vazba mezi nukleotidy RNA. N7 guaninu a 2'-OH prvního a druhého nukleotidu bývají metylovány. Čapka chrání 5'-konec molekuly před exonukleázami a po navázání CBP-proteinu (cap binding protein) je poznána iniciačním faktorem translace elF-3, což umožní správnou vazbu mRNA na ribozom.
Vnitřní methylace. Uvnitř řetězce bývá mRNA metylována především na adenosinu v poloze 6 (m6A). Význam této modifikace nebyl objasněn.
Polyadenylace. Většina eukaryotických mRNA má na konci polyadenylovou sekvenci. Tato úprava se zahajuje specifickou endonukleázou, která rozpozná sekvenci AAUAAA poblíž 3'-konce transkriptu. Další enzym polyA-polymeráza připojí k mRNA postupně asi 250 adeninových nukleotidů. Na ně se pak naváže několik molekul zvláštního proteinu. Polyadenylace je inhibována 3'-deoxyadenosinem (cordycepinem). Také význam této úpravy není jasný.
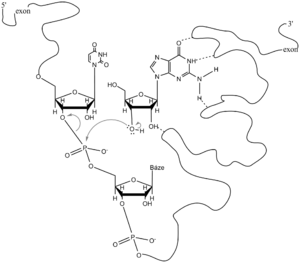
Sestřih (splicing). Eukaryotické strukturní geny jsou na rozdíl od prokaryotických genů přerušovány úseky, tzv. introny, které nejsou součástí funkční mRNA. Zbývající úseky, které jsou po transkripci pospojovány v řetězec zralé RNA,se nazývají exony. Eukaryotická buňka je vybavena mechanismem, který k sobě přiblíží 3'-konec proximálního a 5'-konec následujícího exonu a poté vystřihne intron a spojí oba exony. Proces se nazývá sestřih (angl. splicing). Každý intron u všech eukaryot a všech pre-mRNA začíná sekvencí GUa končí AG. 20–50 nukleotidů směrem k 5'-konci je od 3'-konce intronu důležitá sekvence zvaná větvící místo, která obsahuje adenin. Sestřih začíná štěpením fosfodiesterové vazby mezi 3'-koncem proximálního exonu a 5'-koncem intronu. Fosfát této vazby je přenesen na 2'-OH zmíněného adeninového nukleotidu ve větvícím místě. Je to energeticky nenáročná transesterifikace, při níž vznikne nukleotidová smyčka (klička). Uvolněná 3'-OH na konci proximálního exonu atakuje atom fosforu mezi 3'-koncem intronu a 5'-koncem distálního exonu. Tím se oba exony kovalentně spojí a uvolní se tzv. lasovitá RNA, obsahující sekvenci intronu.
Jednou z důležitých rysů sestřihu pre-mRNA je skutečnost, že při něm nedochází k hydrolýze, nýbrž k transesterifikaci, takže celý děj probíhá na rozdíl od sestřihu pre-tRNA na přibližně stejné energetické úrovni. Je samozřejmě důležité, aby 3'-konec jednoho exonu se přiblížil k 5'-konci následujícího exonu vzdáleným několik set nukleotidů a s přesností na jediný nukleotid se s ním spojil. U savců tento problém řeší ribonukleotidový komplex (60S), zvaný spliceosom. Obsahuje několik malých jaderných RNA (snRNA). U1 snRNA má sekvenci komplementární k místu u 5'-konce intronu, U2 snRNA rozezná větvící místo. Na 3'-konec intronu se navazuje U5 snRNA. Kromě proteinů spliceosom obsahuje ještě U1 a U6 snRNA. U fylogeneticky starších systémů byly objeveny další mechanismy sestřihu. U protozoa Tetrahymena je z prekurzoru 26S rRNA vystřihován intron bez účasti proteinů. Thomas Cech (původem Čech) a Thomas Altman (nositelé Nobelovy ceny) se spolupracovníky objevili, že molekula RNA může vytvořit aktivní enzymové místo sama sobě a katalyzovat svůj sestřih, tedy samosestřih. Reakce vyžaduje kofaktor, kterým může být kterýkoli guaninový ribonukleotid (GTP, GDP, GMP, ale i nukleosid guanosin). Upravovaná RNA se zkonformuje tak, že vytvoří specifické enzymové místo, do kterého se naváže guaninový kofaktor. Na jeho 3'-OH se transesterifikuje 5'-konec intronu. Uvolněná hydroxylová skupina 3'-konce proximálního exonu pak atakuje 5'-fosfát distálního exonu, přičemž se intron uvolní jako lineární molekula. Katalýza je přísně seterospecifická, jak ji známe u proteinových enzymů. Z uvolněného lineárního intronu se po několika úpravách (včetně zkrácení o 19 nukleotidů) vytvoří cirkulární RNA známá pod názvem L19 RNA. Má aktivní místo, které váže guaninový kofaktor a má zvláštní nukleázovou a polymerázovou aktivitu, štěpící a prodlužující oligonukleotidy. Proto se nazývá ribozym. Vědci se domnívají, že v časném období vývoje života se RNA mohla replikovat bez účasti proteinů. V mitochondriích plísní a hub byl nalezen další typ samosestřihu (typ II), který se velice podobá popsanému samosestřihu I (Tetrahymena). Rozdíl je pouze v tom, že u typu II není třeba gauninového kofaktoru, protože 5'-konec intronu se transesterifikuje na 2'-OH adeninového nukleotidu větvícího místa. Intron se uvolní jako lasovitá cirkulární RNA. Samosestřih II.typu je tedy jakýmsi vývojovým mezistupněm mezi I.typem a spliceosmovým typem vyšších eukaryot.
Odkazy[upravit | editovat zdroj]
Související články[upravit | editovat zdroj]
Zdroj[upravit | editovat zdroj]
- ŠTÍPEK, Stanislav. Stručná biochemie : uchování a exprese genetické informace. 1. vydání. Praha : Medprint, 1998. ISBN 80-902036-2-0.
Použitá literatura[upravit | editovat zdroj]
- ŠTÍPEK, Stanislav. Stručná biochemie : uchování a exprese genetické informace. 1. vydání. Praha : Medprint, 1998. ISBN 80-902036-2-0.