Cytoskelet z pohledu biofyziky
Cytoskelet je nepostradatelná součást buňky, která tvoří dynamickou trojrozměrnou opěrnou síť, protkávající celý cytosol. Existence cytoskeletu byla objevena relativně nedávno.
Cytoskelet zajišťuje buňce tvar, mechanickou stabilitu a pohyblivost povrchových specializací - mikroklků, stereocilií a řasinek. Dále se účastní cytoplasmatického transportu pomocí mikrotubulů a proteinových motorů - kinesinů a dyneinů, i pohybu buňky jako takové. Dochází ke spolupráci aktinových filament a proteinových motorů - myosinů, pohyb je realizován pomocí bičíků, lamellipodií a pseupodií. Aktinová mikrofilamenta a intermediální filamenta se upínají do specializovaných částí buněčné membrány a umožňují buňce tvořit mezibuněčná spojení nebo ji přidržují v mezibuněčné hmotě.
Rozdělení filament[upravit | editovat zdroj]
Existují tři typy filament, které tvoří cytoskelet, a to aktinová mikrofilamenta, intermediální filamenta a mikrotubuly. Ty se skládají z jednotlivých proteinů ovlivňující jejich chemické i fyzikální vlastnosti. Jednotlivá filamenta mohou polymerovat (prodlužovat se) nebo depolymerovat (zkracovat se), tím umožňují změnu cytoskeletu v závislosti na potřebách buňky např. při buněčném dělení a pohybu buňky. Disociaci a polymeraci jednotlivých filament ovlivňují doprovodné proteiny, které jsou pro každý typ filamenta specifické. K filamentům můžeme také zařadit centriol.
Aktinová mikrofilamenta[upravit | editovat zdroj]
Aktinová mikrofilamenta s průměrem 5-7 nm se nacházejí ve všech eukaryotních buňkách, největší obsah aktinu má svalovina. Mikrofilamenta se podílí zásadně na udržování tvaru a vnitřní organizaci buňky. Aktinové mikrofilamentum (polypeptid tvořený 375 aminokyselinami) je pružné a je tvořeno dvoušroubovicí fibrilárního F-aktinu se závitem opakujícím se každých 37 nm, který samotný se skládá z globulárních jednotek G-aktinu. [1]
Všechny globulární molekuly aktinu směřují ve vláknu stejným směrem podél osy vlákna. To vytváří v aktinových vláknech polaritu, a tedy rozlišitelný plus+ a mínus- konec. Vlákna na obou koncích stále přirůstají nebo se rozpadají, přičemž rychleji přibývají na plus+ konci. V buňkách se nachází několik typů aktinů, které se liší aminokyselinami, které je tvoří. To způsobuje rozdílnou funkční a strukturní stabilitu. Aktinová vlákna se většinou vyskytují ve svazcích, v sítích nebo v rozvětvení. Podíl aktinu na celkovém množství proteinů v buňce je vysoký - kolem 5%.
Aktinová filamenta, která se nacházejí ve svalových buňkách, jsou modifikována na tzv. myofilamenta a spojená za pomoci tropomyosinu s tlustými myosinovými filamenty. Jsou velmi stabilní. Ve svalových buňkách jsou na rozdíl od ostatních buněk lineárně a pravidelně uspořádaná. Navíc mají kinetickou funkci, kdy převádějí chemickou energii v mechanickou viz Svalový pohyb. V nesvalových buňkách se vyskytuje jak aktin v polymerizované, tak v solubilní formě a dochází k neustálé polymeraci a disociaci aktinových mikrofilament (polymeraci usnadňují a nebo blokují profiliny 1 a 2). Stupeň polymerace aktinu lze ovlivnit změnou hladiny iontů kalcia v cytoplasmě. Polymerace aktinu probíhá tak, že aktinové monomery v cytosolu nesou ATP a po zapojení monomeru do rostoucího aktinového mikrofilamenta dojde k hydrolýze na ADP. Molekuly ADP jsou zachyceny uvnitř vlákna. Při oddělení monomeru může dojít k výměně ADP za ATP a k pozdějšímu opětovnému navázání.
V nesvalových buňkách jsou aktinová mikrofilamenta základem cytoskeletu. Tvoří difuzní síť, která je nejčastěji kondenzována pod buněčnou membránou v tzv. terminální síť (membránový skelet). Terminální síť je navázána na buněčnou membránu pomocí proteinů spektinu a dystrofinu. Samotná aktinová mikrofilamenta jsou vázána k buněčné membráně proteiny α-aktinu, vinkulinu a tropomyosinu. Mikrofilamenta se spojují jak navzájem, tak s intermediálními filamenty, která se nacházejí v hlubší vrstvě. Výsledný membránový skelet slouží hlavně ke stabilizaci buněčné membrány a je navázán na zonula adherens. Nepostradatelnou roli hraje při endocytóze a exocytóze.
Aktinová filamenta jsou součástí povrchových specializací buněk, kde jsou propojeny do uspořádaných systémů (20 napříč provázaných aktinových filament u mikroklku) za pomoci proteinů fimbrin, villin a espin. Aktinová mikrofilamenta jsou nezbytná pro cytoplazmatický a buněčný pohyb. Jsou součástí pseudopodií, lamellipodií a filopodií sloužících k migraci buňky. Při vysunování těchto výběžků – (panožek), jsou aktinová filamenta rychle přestavována a sunou před sebou buněčnou membránu. Aktinová mikrofilamenta hrají významnou úlohu v nitrobuněčném transportu (pohyb granul a vesikul).
Funkce a význam aktinových mikrofilament[upravit | editovat zdroj]
- kinetická funkce – převod chemické energie na mechanickou
- strukturní funkce – mikrofilamenta navzájem příčně „svázaná” jsou strukturním základem některých výběžků buňky - mikroklky, stereocílie
- tvoří terminální síť v oblasti pod buněčnou membránou
- proteinové vlákno podílející se zásadně na udržování tvaru a vnitřní organizaci buňky
- velmi důležité pro nitrobuněčný transport
- podílejí se na tvorbě panožek
Intermediální filamenta[upravit | editovat zdroj]
Intermediální filamenta s průměrem 10-12 nm jsou tvořena dlouhými molekulami, která jsou tvořená globulárními podjednotkami. Vyskytují se téměř ve všech buňkách, a to většinou v cytoplasmě, někdy také v buněčném jádře. Základní podjednotkou je monomer intermediálního filamenta, který obsahuje tyčinkovitou oblast a dva globulární konce, páry se za pomoci globulárních konců spojují do dimerů. Dva dimery se spojí paralelně s určitým posunem a vytvoří tetramery, které se následně paralelně spojují a vytvářejí stočenou strukturu intermediálního filamenta. Intermediální filamenta jsou stabilní, pevná a tvoří oporu pro ostatní buněčné struktury. Velký význam nabývají v patologii, kde pomáhají určit původ a typ tumoru. Imunocytochemickými metodami bylo zjištěno, že intermediární filamenta jsou tvořena různými typy proteinů. Podle toho je můžeme rozdělit do šesti základních tříd, přičemž jednotlivé typy filament bývají typické pro určitou tkáň:
- Cytokeratinová intermediální filamenta – náchází se v epitelových buňkách, tvoří tu drobné svazky- tzv. tonofibrily, vážou se na desmozomy na laterálních stěnách. Dělíme je na kyselá, bazická i neutrální, z nichž vždy dva typy tvoří polymery. Filamenta mohou být tzv. „měkká” obsažená v buňkách epitelových nebo „tvrdá” nacházející se v kožních derivátech.
- Vimentinová intermediální vlákna – nacházejí se v buňkách mezenchymového původu, tj. fixní buňky vaziva, tukové buňky, osteocyty, chondrocyty, dále se vyskytují např. v endotelových buňkách a buňkách obalu CNS. Můžeme je najít i ve Schwannových buňkách.
- Desminová intermediální filamenta – vyskytují se ve všech typech svalových buněk (Z-linii svalových vláken).
- Gliová intermediální filamenta – nachází se ve Schwannových buňkách a v astrocytech.
- Neurofilamenta- jejich polymery mohou být tvořeny třemi typy proteinů (L, M a H). Nacházíme je v cytoplasmě nervových buněk.
- Laminová intermediální filamenta- polymery, které tvoří laminu, nacházející se pod vnitřní jadernou membránou, nacházíme je i v nukleoskeletu.
Samostatným typem jsou intermediální filamenta tvořená nestinem, která nacházíme v kmenových a nediferencovaných buňkách.
Funkce a význam intermediárních filament pro biofyziku[upravit | editovat zdroj]
Díky svým vlastnostem zaujímají intermediální filamenta a zbylé složky cytoskeletu významnou pozici v biomechanice tkání. K těmto vlastnostem řadíme především jejich pevnost v tahu a tím podpůrnou funkci skeletu buňky a její mechanickou stabilizaci. Zabraňují deformaci buněk. Vázaná na desmozomy zajišťují správné stahy ve svalovině nebo mechanickou pevnost v kůži. Hrají důležitou roli v buněčném dělení. Pomocí jejich rychlého rozpadu je umožněn pohyb chromozomů, jejich splynutí a následné rozdělení do dvou samostatných jader.
Tím, že jsou filamenta (nejen intermediální) tvořena proteiny, které mohou polymerizovat a asociovat, ale také disociovat či depolymerizovat do původního stavu, umožňují rychlou přestavbu buněk, nutnou například při buněčném dělení či při migraci buněk. V tomto mechanismu hrají významnou roli také proteiny asociované s jednotlivými typy filament. U intermediárních filament je to např. plektin.
Mikrotubuly[upravit | editovat zdroj]
Mikrotubuly s vnějším průměrem 24 nm a s tloušťkou stěny 5 nm se nachází ve většině eukaryotních buněk. Mikrotubuly jsou tubulární (struktura "spirály"), pevné a nevětvící se struktury, jejichž stěna je tvořena 13 protofilamenty. Základní bílkovinou mikrotubulů je tubulin – heterodimer tvořený dvěma podjednotkami, jež se liší primární strukturou a označují se jako α,β. Jedná se o polarizované molekuly (plus- a mínus- konec), které podélnou polymerací tvoří protofilamenta. γ-tubulin - nepolymeruje do vláken a je součástí mikrotubuly organizujících center (MTOC). Při růstu se uplatnují dva typy dimerů, jedny nesousí GTP a druhé s navázaným GDP. Mikrotubuly s navázaným GTP pokračují v růstu tzv. GTP-čepička. Pokud dojde k hydrolýze GTP čepičky na GDP, jsou polymery méně pevně vázány a dochází k rozpadu a zkracování mikrotubulu. Růst mikrotubulů probíhá přidáváním heterodimérů na tzv. plus-konec. Při polymeraci hraje velkou roli fosforylace a defosforylace doprovodných proteinů, které jsou k mikrotubulu připojeny. Aby nedošlo k depolymeraci mikrotubulu je nutné, aby byli oba konce chráněné před depolymerací. To je zajištěno ukotvením mínus-konce do organizačního centra, odkud vyrůstá a plus-konec může být stabilizován navázaním specifických proteinů.
Mikrotubuly jsou buď nepravidelně uspořádány, a nebo jsou součástí buněčných struktur (dělící vřeténko a centriola). Zajišťují hlavně tvar buňky (mechanická opora), dále jsou nezbytné pro intracelulární transport (např. vesikuly, granula a transport látek mezi endoplazmatickým retikulem a Golgiho komplexem) a jsou součástí pohybového aparátu řasinek a bičíků. V průběhu mitózy vytvářejí mitotické vřeténko a umožňují tak pohyb chromozomů. Při všech zmíněných dějích jsou důležité proteiny připojené k mikrotubulům tzv. MAPs.
Pro intracelulární transport jsou mikrotubuly nezastupitelné, protože představují vodící linku pro transportní částice, které se po nich pohybují za pomoci tzv. motorických proteinů. Tyto molekuly mají dva póly, jeden pól obsahuje receptor navázaný na transportní vesikuly a druhý se dvěmi globulárními strukturami navázanými na mikrotubul. Po navázání ATP dojde na globulární části k hydrolýze a uvolněná energie slouží ke změně konfigurace molekuly. Molekula kinesinu zajišťuje pohyb k + konci a molekula dyneinu k - konci. Dyneiny transportují k centrosomu, kinesiny pak směrem k buněčné membráně. V mitotickém vřeténku se pohyb zajišťuje depolymerací + konce. Při buněčném dělení jsou mikrotubuly důležité pro transport chromozomů.
Centriol je komplexní struktura tvořená pravidelně uspořádanými mikrotubuly. Centriol připomíná tvarem dutý válec o délce 0,3-0,5 µm. Stěna centriolu je tvořena devíti triplety mikrotubulů, označených A, B a C. Mikrotubulus A je nejblíže středu centriolu a má všech 13 protofilament. Ostatní některá protofilamenta sdílejí, jsou nekompletní. K centriolu naléhá tzv. oblast pericentriolárního materiálu, který se uplatňuje při polymeraci mikrotubulů (obsahuje prstence γ-tubulinu a proteiny potřebné k tvorbě mikrotubulu), které se radiálně šíří do okolní cytoplasmy. Buňka obsahuje jeden pár centriolů v blízkosti jádra a Golgiho komplexu (pokud neprobíhá buněčné dělení).Centrosom je název pro pár centriol, které jsou na sebe kolmé svými dlouhými osami a pericentriolární materiál. Centrosom je někdy nazýván centrum organizující mikrotubuly (MTOC), protože zde jsou mikrotubuly ukotvené a vznikají i nové. Mikrotubuly vyrůstající z centrosomu jsou velmi proměnlivé, protože neustále rostou a nebo se zkracují. Procentrioly (dceřiné) vznikají v blízkosti původního centriolu, které putují k protilehlým pólům buňky a vzniká mitotické vřeténko. Hlavní funkcí je tvorba mikrotubulů, účastnící se buněčného dělení viz buněčný cyklus.
Kinocilie (řasinky) a bičíky patří mezi pohyblivé buněčné výběžky, vyrůstající z kinetosomu (pod bází cilie-bazální tělíska). Uspořádání mikrotubulů je v kinocilii a nebo bičíku eukaryot pevně dané.
Uprostřed kinofibrily (bičíky - flagelá a řasinky - cilie) se nachází centrální pár mikrotubulů. Po obvodu se pak nachází devět zdvojených mikrotubulů, které obsahují dvě řady dyneinových molekul. Ty jsou navázány na sousední mikrotubuly a spojováním, nebo posunem dyneinových hlaviček dochází k pohybu řasinky, za spotřeby ATP. Pohyb se opakuje v cyklech, které se skládají z fáze pohybu-ohnutí (silový úder) a pomalého návratu, opakujících se po 0,1- 0,2 vteřinách.
Bičík má stejné uspořádání jako řasinka, vzorec 9x2+2. Dvojice mikrotubulů jsou pevně spojeny proteiny, které rozdělují bičík na jednotlivé segmenty. Posun dyneinů vyvolá prohnutí v segmentu a tím i výsledný pohyb celého bičíku. Délka bičíků je asi 100-200 μm.
Cílie se pohybují zpravidla v jednom směru (kinocilie) a zabezpečují posun různých částic, sekretů a tekutin daným směrem. Nepohyblivé cilie (stereocílie) – u nich pohyblivost závisí na vnitřní synchronizaci s pohyblivostí podložky.
Neurofibrily jsou typické pro specializované nervové buňky, Slouží na vedení vzruchu, který se nimi šíří přibližně rychlostí 120m/s.
Tonofibrily jsou bílkovinné vlákna z kolagenu a elastinu, které jsou součástí některých pojivových tkání. Dodávají tkáním mechanickou pevnost.
Funkce a význam mikrotubulů pro biofyziku[upravit | editovat zdroj]
Mikrotubuly jsou dynamické struktury, ve kterých neustále probíhá výměna polymerizovaných molekul za molekuly depolymerizované. Uspořádání mikrotubulů v buňce závisí na funkci, kterou zprostředkovávají. Difúzně uspořádané mikrotubuly především udržují tvar buněk, při porušení dochází ke ztrátě specializovaného tvaru buňky. Mikrotubuly plní důležitou úlohu i při intracelulárním transportu a účastní se transportu látek v drobných vezikulách mezi endoplazmatickým retikulem a Golgiho komplexem. Jejich další velmi důležitá funkce je při buněčném dělení, kdy vytváří dělící vřeténko a zprostředkovávají tím pohyb chromozomů.
Motorické proteiny[upravit | editovat zdroj]
Motorické proteiny řadíme do třídy tzv. molekulárních motorů – molekul, jejichž vlastností buňka využívá k nitrobuněčnému transportu vesikul, granul a organel, případně k dalším specializovaným procesům (např. svalový stah, ciliární aparát). Pro svou funkci vyžadují chemickou energii uvolňovanou hydrolýzou nejčastěji ATP, méně často GTP, kterou přeměňují v energii mechanickou. Jako dráhu pro pohyb využívají motorické proteiny cytoskeletární síť – mikrofilamenta (aktin) nebo mikrotubuly. Poruchy správné funkce motorických proteinů se manifestují často jako závažná onemocnění – př. myopatie, chronické infekce dýchacích cest, neplodnost.
V buňkách lidského organismu nejčastěji nacházíme tři základní skupiny motorických proteinů – myosin, kinesin a dynein.
Myosin[upravit | editovat zdroj]
Myosin představuje skupinu ATP-dependentních motorických proteinů, které tvoří součást cytoskeletu všech živočišných a některých rostlinných eukaryotických buněk. Zajišťují intracelulární transport partikulí a spolu s dalším proteinem, aktinem,se podílí na stahu svalových vláken.
Struktura: Všechny druhy myosinu se skládají z globulární hlavičky (head domain), krčku (neck domain, lever arm) a ocásku (tail domain). Myosin II, který je hojně zastoupen v lidských buňkách, je tvořen 6 vlákny - 2 těžkými a 4 lehkými (2 regulační a 2 esenciální). Těžká vlákna se splétají do dvojšroubovice tvořící dlouhý ocásek. Dále se dvojšroubovice již nesplétá, krček a 2 globulární hlavičky jsou tedy tvořeny vždy jen jedním těžkým vláknem. Každou hlavičku přitom obtáčí 2 lehká vlákna (1 regulační a 1 esenciální). Krček spojuje hlavičky s ocáskem, má strukturu „pákového ramene“, je velmi pružný. Globulární hlavička (head domain) se váže na aktin a probíhá zde hydrolýza ATP, která vede k přeměně chemické energie z ATP na mechanickou energii pohybu. Krček zajišťuje převod síly vzniklé v oblasti globulárních hlaviček směrem k ocásku. Může být také spojkou pro myosinová lehká vlákna. Dochází zde k navázání kalmodulinu (protein transportující Ca2+ ionty, díky kterým globulární hlavičky myosinu II začínají kráčet po aktinu a způsobují tak kontrakci svalových vláken). Ocásek zprostředkovává interakci s přenášenou partikulí. Dochází tedy k navázání partikule k této doméně.
Pohyb: Po hydrolýze ATP dochází k tahu těžkých vláken krčku. Globulární hlavičky nasedají na aktinová mikrofilamenta a kráčivým pohybem se posouvají směrem dopředu k plus-konci filament. Výjimku tvoří myosin IV, VI, a IX pohybující se ve směru k mínus-konci. Tím je partikule navázaná na druhý konec myosinu, tj. ocásek, transportována podél filament cytoskeletu. Délka kroku je u myosinu jednoho druhu konstantní, jelikož síla působí na krček pod stále stejným úhlem. Závisí ale na délce krčku - čím delší krček je, tím delší je i krok. Proto se délka kroku u různých druhů myosinu liší. Rychlost pohybu motorického proteinu je dána především rychlostí hydrolýzy ATP.
Klasifikace: Rozlišujeme 18 druhů myosinu značených římskými číslicemi I – XVIII, které tvoří „myosinovou superrodinu“ kódovanou asi 150 geny (lidský genom obsahuje asi 40 genů kódujících myosin). Tyto druhy se od sebe liší pouze jednotlivými složkami tvořícími ocásek a sekvencí aminokyselin v ATP-hydrolytických doménách.
- Myosin I – monomer, je nejčastější a zajišťuje transport vesikul uvnitř buněk. Délka jeho kroku je 10 nm.
- Myosin II – tvoří ho více molekul, objevuje se především ve svalových buňkách (ale i v jiných!) a zajišťuje kontrakci svalových vláken. Ve svalových buňkách tlustého vlákna sarkomery se ocásky (tail domains) spojí a hlavičky vyčnívají a kráčí po tenkých vláknech aktinu.
- Myosin III – je v buňkách lidské sítnice a v hlemýždi.
- Myosin V – dimer, který přenáší vesikuly a organely k periferii buňky do míst s větší koncentrací aktiniových filament. Pohybuje se buď rotačním pohybem („hand over hand“ – jedna globulární hlavička je navázána na aktiniové mikrofilamentum a druhá se kolem ní obtáčí), nebo pohybem píďalkovitým („inchworm“). Délka jednoho kroku je 37 nm.
- Myosin VI – objevuje se jako dimer i monomer a transportuje endocytované vesikuly (endosomální kompartmenty) do centra buňky. Kráčí směrem k – konci aktinových filament.
- Myosin IX – má jen jednu globulární hlavičku a kráčí směrem k – konci.
Dynein[upravit | editovat zdroj]
Je motorický protein, který má za úkol přenášet molekuly látek pohybem po kolejnici mikrotubulu směrem k jeho minus konci. Tento způsob přepravy se nazývá retrográdní transport. Dyneiny pracují jako tzv. molekulové motory. Přeměňují chemickou energii uloženou v ATP na mechanickou energii pohybu pomocí hydrolýzy ATP.
Struktura: Dyneiny tvoří obrovské komplexy bílkovin, které obsahují několik polypeptidových podjednotek. Molekuly dyneinu lze zařadit do dvou skupin - cytoplazmatické dyneiny a ciliární dyneiny.
Cytoplazmatický dynein: Je dvouhlavá molekula s dvěma téměř identickými těžkými řetězci, které tvoří domény hlavy a jedním lehkým řetězcem, tvořícím nožku. Hlavy obsahují aktivitu ATPázy a umožnují tak pohyb podél mikrotubulu. Obě hlavy tvoří výběžky, jeden se připevňuje přímo k povrchu mikrotubulu, druhý se naváže na lehký řetězec a připojí tak dynein k nesoucí molekule.
Ciliární dynein: Tvoří jeden až tři těžké řetězce, z nichž každý obsahuje kulovitou doménu a dva výběžky. Jeden se váže na mikrotubul, druhý se napojuje k jinému dyneinu. Mezi dyneiny tak dochází k vytvoření příčného můstku, který se později uplatňuje při silovém zdvihu, kdy za pomocí AAA ATPázy dochází ke konformační změně. Ta způsobuje vzájemné posouvání mikrotubulů, které umožňují ohýbaní řasinek a v důsledku toho přenos molekuly
Funkce: Cytoplazmatický dynein: Vykytuje se ve všech živočišných buňkách a jeho hlavní funkcí je přenos vesikul a buněčných organel. Tím přispívá i k umístění jednotlivých organel v buňce. Důležitou úlohu hraje také v průběhu dělení buňky, kdy zprostředkovává pohyb chromozomů a určuje polohu dělícího vřeténka.
Ciliární dynein: Nachází se pouze v buňkách, obsahujících řasinky nebo bičíky. Hlavní funkcí je právě pohyb těchto struktur.
Kinesin[upravit | editovat zdroj]
Kinesin je další motorický protein. Existuje více typů kinesinů, mezi kterými je rozdíl především v typu aminokyseliny umístěné v hlavě. Spolu s cytoplazmatickým dyneinem zajišťují transport partikulí podél mikrotubulů. Funkcí kinesinu je především transport organel a vesikul. Dále se podílí na procesu dělení buňky - cytokinese, dělení jádra - karyokinese a zároveň na přenosu nervového vzruchu.
Struktura: Molekula kinesinu se liší podle jednotlivých typů. Typický kinesin se skládá z dvou polymerů-těžkých řetězců, které mají dva póly. Jeden pól obsahuje receptor s dvěma lehkými řetězci, kterým se připojuje transportovaná partikule k motorickému proteinu. Druhý pól s aktivitou ATP-ázy nese dvě globulární struktury a slouží pro připojení proteinu k mikrotubulu.
Funkce: Po navázání ATP dojde k hydrolýze a uvolněná energie je použita na změnu konfigurace kinesinu. Při navázání jednoho ATP se protein posune o 8 nm. Mechanismus samotného posunutí není zcela prozkoumán. Opakování tohoto cyklu zajistí pohyb partikule podél mikrotubulu. Motorický protein kinesin je odpovědný za transport od mínus konce mikrotubulu k plus konci, výjimečně i opačně.
Fyzikální základy buněčných pohybů[upravit | editovat zdroj]
Cytoskelet hraje v buňce úlohu při držení pevnosti a tvaru buňky, ale je to i důležitá část buňky, která je plně zodpovědná za pohyb. Pohyby můžeme rozdělovat podle toho, jestli se jedná se jedná o pohyb v rámci jedné buňky, nitrobuněčný transport, pohyb brvami a bičíky, pohyb amoeboidní nebo jestli se jedná o pohyb více buněk, které tvoří určitou tkáň, např. svalové kontrakce.
Nitrobuněčný transport[upravit | editovat zdroj]
Ve světelné mikroskopii můžeme pozorovat, jak se cytoplasma buňky a její součásti pohybují, i když se jedná o přerušovaný a trhaný pohyb. Tento transport uvnitř buňky zprostředkovávají jak mikrotubuly, tak aktinová filamenta a jsou do něho zapojeny molekulové motory. Molekulové motory jsou bílkoviny, které se vážou k oběma zmiňovaným elementů cytoskeletu a přeměnují energii získanou z opakovaných cyklů hydrolýzy ATP v mechanický pohyb. Posunují se podél aktinových filament a mikrotubulů vždy v jednom směru a nesou další buněčné komponenty, jež se na tyto molekulové motory vážou a jež jsou posunovány podél vláken. Bylo zjištěno, že existují desítky takových molekulových motorů, lišící se typem vázaného vlákna, směrem vykonávaného pohybu podél vláken a podle přenášeného nákladu. Mezi molekulové motory patří kinesiny a dyneiny.
Pohyb svalový[upravit | editovat zdroj]
Svalový pohyb je nejčastějším druhem buněčného pohybu u člověka. V rámci svalové kontrakce, která bude popsána níže, se kontrahují celé soubory buněk, popřípadě soubuní (syncitia).
Na svalové kontrakci se podílejí aktinová mikrofilamenta (5-7 nm), tenká i tlustá myofilamenta (15-16 nm), ve kterých je fixován myosin. Princip svalové kontrakce je založen na vzájemném samovolném navázaní aktinu, ze kterého je tvořena dvoušroubovice aktinových mikrofilament, a myosinu (aktin vážící motorický protein), který se nachází na koncích,“golfových holích”, tlustých myofilament. Svalové kontrakce se zúčastní i tenká myofilamenta, která jsou navázána na aktinovou šroubovici a buď blokují, nebo odkrývají vazebná místa pro myosin na šroubovici. Při tomto ději dochází ke zkracování aktinu, zatímco délka myosinu zůstává stejná. K celé svalové kontrakci je rovněž zapotřebí suficientní koncentrace adenosintrifosfátu (ATP) a vápenatých kationtů.
Pohyb řasinkami a bičíky[upravit | editovat zdroj]
Tento druh pohybu se uskutečňuje pouze v tekutém prostředí. Vyskytuje se zejména u jednobuněčných organismů, ale také u epitelových buněk a spermií.
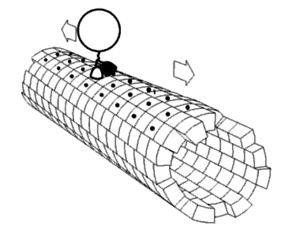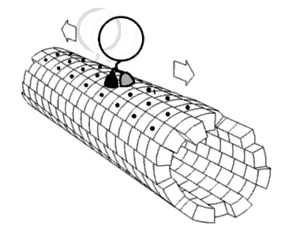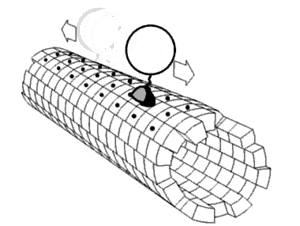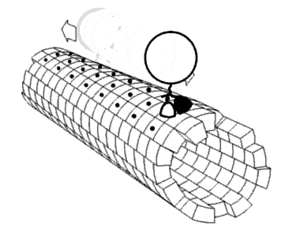
Každá řasinka se pohybuje bičovitým způsobem. Bičíky pohánějící spermie a mnohé druhy prvoků jsou velice podobné řasinkám, jsou ale většinou mnohokrát delší. Bičíky jsou uzpůsobené k pohybu celou buňkou - vyvíjejí pravidelné vlnovité pohyby, kterou buňku posunují v kapalině. Bičík je ovládán molekulárním rotačním motorem uloženým v cytoplasmě těsně pod buněčnou membránou. Motor funguje na základě elektrochemického gradientu a je poháněn sodnými a vodíkovými kationty. Skládá se z 9 párů mikrotubulů uložených kolem centrální dvojice mikrotubulů. V důsledku posunu mikrotubulů v oblasti centrálního mikrotubulového páru umožněnému i pomocnou funkcí dyneinu, který je zde ve formě dyneinových ramének, struktuře spojující periferní mikrotubuly, dojde k ohnutí řasinky.
Pohyb amoeboidní[upravit | editovat zdroj]
Tímto způsobem se v lidském organismu pohybují především leukocyty a někteří průvodci nemocí. U jednobuněčných organismů je nejběžnějším pohybem. Po obvodu buňky je tužší vrstva, která je bohatá na aktinová mikrofilamenta. Filamenta spolu interagují a vytváří hydrostatický tlak cytoplazmy. Cytoplazma tak vytlačuje vrstvičku na povrch buňky a vzniká pseudopodie.
Cytoskeletální vlákna – evoluce a prokaryotická analogie[upravit | editovat zdroj]
Přítomnost cytoskeletu jako dynamické kostry buňky byl dlouho považován za znak specifický pro eukaryotní buňku. V posledních letech byly ale i u prokaryota nalezeny obdoby jednotlivých eukaryotických proteinů, tvořících uspořádaná vlákna.
FtsZ hraje zásadní roli v dělení prokaryotické buňky a je obdobou eukaryotického tubulínu – jeho polymerizace má podobnou dynamiku a kontrolují ji obdobné proteiny. [2]
MreB a ParM jsou proteiny analogické s aktinem, stavba filament je podobná a mají také shodnou funkci: MreB je zodpovědný za udržování tvaru buňky a ParM za intracelulární transport. [3]
Obdobou intermediálních filament je u prokaryotů crescentín.
Podobná struktura cytoskeletálních vláken naznačuje, že vznik cytoskeletu nebyl evoluční událostí specifickou pro eukaryotní buňku, ale že již prokaryotická buňka obsahovala pestrou paletu těchto vláken, které se pak dál modifikovaly v souvislosti s odlišnými nároky prostředí na prokaryotické a eukaryotické organismy.
Odkazy[upravit | editovat zdroj]
Související články[upravit | editovat zdroj]
Externí odkazy a zdroje[upravit | editovat zdroj]
- FILOVÁ, Eva. Byofizika buňky a tkání [online]. [cit. 2014-12-03]. <https://moodle.mefanet.cz/login/index.php>.
- KOTYK, Arnošt. Kinesin se pohybuje vpřed i vzad stejným mechanismem [online]. [cit. 2014-12-02]. <http://www.akademon.cz/clanekDetail.asp?name=Kinesin%20se%20pohybuje%20vpred%20i%20vzad%20stejnym%20mechanismem&source=0605>.
- NEČAS, Oldřich. Molekulové motory [online]. [cit. 2014-12-02]. <http://www.vesmir.cz/clanek/molekulove-motory>.
- VÁCHA, Martin., et al. Srovnávací fyziologie živočichů [online]. MU Brno, ©2004. [cit. 2015-01-06]. <http://www.med.muni.cz/~mpesl/trafficjam/Prirodu/priro/kap8.pdf>.
Reference[upravit | editovat zdroj]
- ↑ FILOVÁ, Eva. Biofyzika buňky a tkání [online]. ©11/2014. [cit. 2015-01-06]. <https://moodle.mefanet.cz/login/index.php>.
- ↑ VAN DEN ENT F,, AMOS LA a LÖWE J.. Structural/functional homology between the bacterial and eukaryotic cytoskeletons [online]. ©2004. [cit. 2015-01-06]. <https://www.ncbi.nlm.nih.gov/pubmed/15037301>.
- ↑ VAN DEN ENT F,, AMOS LA a LÖWE J.. Prokaryotic origin of the actin cytoskeleton [online]. ©2004. [cit. 2015-01-06]. <https://www.ncbi.nlm.nih.gov/pubmed/11544518>.
Použitá literatura[upravit | editovat zdroj]
- LÜLLMANN-RAUCH, Renate. Histologie. 3. vydání. Praha : Grada Publishing a.s., 2012. 567 s. ISBN 978-80-247-3729-4.
- VAJNER, Luděk, Jiří UHLÍK a Václava KONRÁDOVÁ. Lékařská histologie I : Cytologie a obecná histologie. 2. vydání. Praha : Nakladatelství Karolinum, 2010. 110 s. ISBN 978-80-246-1860-9.
- ALBERTS, Bruce, Dennis BRAY a Alexander JOHNSON, et al. Základy buněčné biologie : Úvod do molekulární biologie buňky. 2. vydání. Ústí nad Labem : Espero Publishing, 2006. 740 s. ISBN 80-902906-2-0.