Diseminovaná intravaskulární koagulace
(přesměrováno z DIC)
Diseminovaná intravaskulární koagulace (DIC, lat. dis-sēmināta – roze-setá) je získaný stav vyznačující se patologicky zvýšenou koagulační aktivitou s tvorbou trombů v periferní cirkulaci a postupným vyčerpáním koagulačních faktorů, který následně vede k zvýšení krvácivosti. Vyskytuje se jak v akutní tak i v chronické formě.
DIC vzniká vždy sekundárně jako odpověď na určitý tkáňový inzult.
- Rizikové faktory zapříčiňující vznik DIC
- sepse,
- trauma, především neurotrauma,
- nádorové onemocnění,
- těžká potransfusní reakce,
- revmatologické onemocnění,
- gynekologicko-porodnické komplikace: embolie plodové vody, abrupce placenty, HELLP syndrom, eklampsie, syndrom mrtvého plodu;
 Podrobnější informace naleznete na stránce DIC (gynekologie a porodnictví).
Podrobnější informace naleznete na stránce DIC (gynekologie a porodnictví). - těžké selhání jater,
- poruchy mikrocirkulace (šokové stavy),
- vystavení cirkulující krve cizorodým materiálům (mimotělní oběh).[1]
- Pravidlo čtyř P (orgány nejčastěji se podílející na vzniku DIC). Orgány, které jsou bohaté na trombokinázu.
- Plíce.
- Prostata.
- Pankreas.
- Placenta.[2]
- Za těchto patologických stavů se mohou dostat do cévního systému
- buňky z jiných tkání (např. během porodu (aspirace plodové tekutiny), těžkého poranění, operace nebo při proniknutí metastatických buněk do oběhu),
- patologické myelo/lymfoproliferační buňky,
- endotelie a monocyty aktivované cytokiny (hlavně TNF a IL-1) a endotoxinem (systémové záněty (hlavně septický šok způsobený gram-negativními bakteriemi, které ve své buněčné stěně nesou endotoxin)),
- cytoplazmatický tkáňový faktor uvolněný z lyzovaných erytrocytů.
Patofyziologie[upravit | editovat zdroj]
Fyziologická koagulace je lokální záležitost, avšak DIC (jak už z názvu vyplývá) je koagulace nekontrolovaně „rozšířena“ na mnohých místech cévního řečiště.
- Zásadní faktory v patofyziologii DIC
- zvýšená produkce trombinu,
- suprese antikoagulačních mechanismů,
- porucha fibrinolýzy,
- aktivace zánětu.
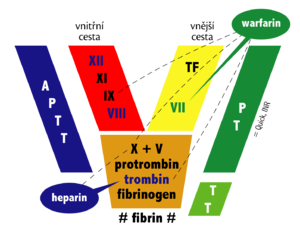
Celý proces je nastartován aktivací "vnějšího (extravaskulárního) systému" koagulace – aktivací plazmatického koagulačního faktoru VII navázáním na tkáňový faktor III. Tkáňový faktor je látka obsažená ve fosfolipidové membráně buněk a v cirkulaci se za normálních okolností nevyskytuje. Je však přítomna extravazálně nebo v některých krvinkách, které ho ale neexprimují na svůj povrch. Kromě aktivace faktoru IX (aktivace vnitřního systému vnějším) a X je faktor VII schopen aktivovat i sám sebe. Aktivace faktoru IX vede dále ke zvýšené produkci aktivovaného faktoru X. Aktivovaný faktor X pak vede k přeměně protrombinu na trombin a následnému štěpení fibrinogenu na fibrin monomer, který vytváří vlákna – fibrin polymer – a vede k tvorbě intravaskulární "fibrinové sítě". Trombin také aktivuje krevní destičky. Aktivace zahrnuje změny tvaru destiček, zvýšený pohyb, uvolnění obsahu jejich granul a agregaci[3]. Tato diseminovaná koagulační aktivita způsobuje mikroembolizace do periferie, čímž výrazně narušuje orgánovou perfuzi a napomáhá rozvoji ischemie v postižených oblastech.
Koagulační a antikoagulační systém je za normální situace v rovnováze. Koagulace je regulována jednak zpětnou vazbou mezi jednotlivými stupni koagulační kaskády a dále pak cirkulujícímí inhibitory koagulace. Nejúčinější je antitrombin III, který svou vazbou na trombin a další faktory koagulační kaskády (IXa, Xa, XIa, XIIa) inhibuje jejich činnost. Účinek antitrombinu III představuje asi 75 % antitrombinové aktivity. Zbylých 25 % představují faktory jako α2-makroglobulin, heparin kofaktor II a α1-antitrypsin[3]. Aktivitu antitrombinu III zvyšuje přítomnost kyselých proteoglykanů jako je heparin. Heparin navázaný na antitrombin mění jeho konformaci a umožňuje vazbu na další substráty. Trombin se dále váže s trombomodulinem a přeměňuje protein C na aktivní protein C, který ve spojení s jeho kofaktorem proteinem S, degraduje aktivované koagulační faktory V a VIII[3].
Vytvořené fibrinové řetězce jsou štěpeny aktivovaným produktem plasminogenu, plasminem, který je aktivován působením tkáňového aktivátoru plasminogenu tPA, na degradační produkty fibrinu.
Koagulační a antikoagulační děje jsou úzce spjaty se zánětlivou reakcí a mnohé proteiny zúčastněné v koagulačním řetězci jsou zároveň proteiny akutní fáze zánětlivé reakce. Při rozvoji DIC se uplatňuje jednak koagulační a antikoagulační aktivita, ale také zánětlivá reakce, která dále prohlubuje DIC. Antitrombin je během DIC spotřebováván na inhibici koagulace a zároveň je štěpen elestázou produkovanou neutrofily aktivovanými zánětlivou reakcí. Navíc může být narušena i produkce antitrombinu v játrech jako následek poškození jater nedostatečnou perfuzí a ischemií, způsobenou mikroembolizacemi v jaterních cévách[4]. Antikoagulační aktivitu narušuje i spotřeba dalších faktorů koagulace a antikoagulace. Zánětlivé cytokiny snižují expresi trombomodulinu na buněčných membránách. Fibrinolýza a antikoagulace proto nemohou udržet krok s přibývající aktivitou koagulace, což vede k další mikroembolizaci do tkání, rozvoji ischemie, orgánovému poškození, rozvoji zánětu a SIRS a vzniku MODS, vyčerpání koagulačních a antikoagulačních faktorů a následnému krvácení s rozvojem šoku, ke kterému přispívá i zánětlivá aktivita zvýšenou permeabilitou cévních stěn a únikem tekutin z intravazálního prostoru.
Klinický průběh[upravit | editovat zdroj]
Akutní forma[upravit | editovat zdroj]
- etiologie: infekce, sepse, polytraumata, popáleniny, hemolytické transfuzní reakce, těžká jaterní onemocnění;
- rozvíjí se během několika minut až hodin;
- může převládat krvácivá nebo trombotická složka (dle charakteru základního onemocnění a výchozího stavu koagulace);
- krvácení může být mírné (z čerstvých vpichů a ran) i dramatické, život ohrožující – purpura fulminans – rozsáhlé krvácení do kůže spojené s horečkou a hypotenzí;
- trombózy v mirkocirkulaci → postižení ledvin, jater, plic a CNS → až multiorgánové selhání;
- okluze větších cév končetin → gangréna.[5]
Akutní DIC probíhá ve čtyřech fázích:
- Iniciální stádium (triggerstadium):
- začátek aktivace koagulačního stavu při jednom z rizikových onemocnění, stádium hyperkoagulace zatím beze změn ve výsledcích laboratorních vyšetření,
- Kompenzovaná DIC (hyperkoagulační fáze):
- počínající změny laboratorních vyšetření, počínající fibrinolýza a zvýšená spotřeba koagulačních faktorů,
- Manifestní subakutní DIC (hyperfibrinolytická fáze):
- snížení koagulace, hemoragické diatézy, zvýšená spotřeba koagulačních faktorů a zvýšená fibrinolýza, typické změny laboratorních vyšetření,
- Dekompenzovaná DIC:
- masivně snížená koagulace, hemoragické diatézy, masivní fibrinolýza, typické změny laboratorních vyšetření.[6]
Chronická forma[upravit | editovat zdroj]
- etiologie: nádorová onemocnění, rozsáhlé cévní malformace, autoimunitní choroby;
- rozvíjí se během dní až týdnů;
- klinicky bývá asymptomatická;
- diagnostika laboratorní vyšetření koagulace;
- může za určitých okolností přejít do akutní formy.[5]
Klinický obraz[upravit | editovat zdroj]
Kombinace defektu koagulace (snížená koncentrace prokoagulačních faktorů) s defektem primární hemostázy (trombocytopenie) vede k poruchám v následujcících orgánových systémech:
- Cirkulace: spontánní, těžce stavitelné krvácení, petechie a podkožní krvácení, difúzně lokalizované trombózy.
- Kardiovaskulární systém: hypotenze, tachykardie, rozvoj šoku.
- Nervový systém: ložiskové změny (následky mikroembolizace), poruchy vědomí.
- GIT: meléna, hematemeze.
- Urogenitální systém: hematurie, metroragie, oligurie.[7]
Komplikace[upravit | editovat zdroj]
Tento stav může být komplikovaný embolizacemi do různých orgánových systémů. Hlavně: ledviny (akutní renální selhání), plíce (ARDS), CNS (cévní mozkové příhody), cirkulace (rozvoj šoku).
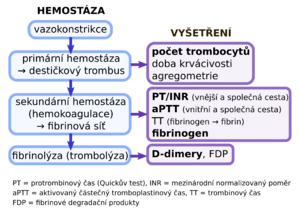
Diagnóza[upravit | editovat zdroj]
Pro diagnózu DIC neexistuje žádný přímý laboratorní test. Diagnózu je proto nutné určit dle anamnézy, klinického stavu pacienta a pomocných laboratorních vyšetření.
- vyšetření koagulace aPTT a PT je prodloužené resp. zvýšené,
- hladina antitrombinu III a faktorů V a VII je snížená,
- zvýšená koncentrace FDP (fibrin degradation products, FDP) a D-dimerů, specificita těchto testů je však limitována tím, že oba markery jsou zvýšené u stavů jako trauma, operace, trombembolismus,
- snížená koncentrace fibrinogenu,
- trombocytopenie.[8]
Scoring pro diagnostiku DIC
| Rizikové faktory | Sepse, trauma, gynekologicko-porodnické komplikace spojené s možným výskytem DIC |
| Laboratoř | Stanovení trombocytů, FDP´s, fibrinogenu, AT III, aPTT, PT |
| Scoring | Trombocyty > 100 0 bodů, < 100 1 bod, < 50 2 body
Markery degradace fibrinu (FDP) bez elevace 0 bodů, mírná elevace 2 body, masivní elevace 3 body Prodloužené PT < 3 s 0 bodů, 3–6 s 1 bod, > 6 s 2 body Fibrinogen > 1g/l 0 bodů, < 1g/l 1bod |
Skóre 5 a více spolu s rizikovými faktory svědčí pro DIC – skóring opakujeme denně [8]
Diferenciální diagnóza[upravit | editovat zdroj]
- jiné konsumpční koagulopatie,
- trauma, velké krevní ztráty, operace a následná náhrada ztrát (volumoterapie) spolu se zředěním koagulačních faktorů,
- trombocytopenie,
- hemolyticko uremický syndrom (HUS),
- idiopatická trombocytopenická purpura,
- heparinem navozená trombocytopenie[8].
Léčba[upravit | editovat zdroj]
- Terapie primárního onemocnění – odstranění příčiny DIC.
- Stabilizace oběhu, adekvátní ventilační podpora, zajištění diurézy.
- Léčba koagulační poruchy – přerušení aktivace (antitrombin, heparin – u chronické formy) a doplnění chybějících složek s cílem dosáhnout účinných hladin koagulačních faktorů, fibrinogenu a trombocytů:
- trombokoncentrát – k udržení počtu trombocytů optimálně > 50 × 109/l;
- čerstvá mražená plazma – při krvácivých projevech a prodloužení PT;
- fibrinogen – při poklesu pod 1 g/l;
- antitrombin – u chronické formy DIC, s cílem dosáhnout 100-120% hladiny antitrombinu III;
- heparin – kontroverzní, používá se u chronické formy DIC;
- aktivovaný protein C;
- rekombinantní aktivovaný faktor VII.[5]
Čerstvá mražená plazma obsahuje všechny pro- a anti-koagulační faktory (závisí ale na koncentracích těchto faktorů v plasmě dárce). FFP ale také obsahuje značné množství vody, albuminu a ostatních plazmatických bílkovin, proto může transfuze velkého množství plasmy vyvolat dekompenzaci především u kardiálně nestabilních pacientů. Někteří autoři však považují podání heparinu za sporné. Cave! Heparin nepodáváme krvácejícím pacientům. Heparin účinkuje pouze pokud je dostatečná plasmatická koncentrace AT III (více než 70 % normy). Proto je nutné znát jeho koncentrace a případně je doplnit infuzí. Speciální koncentráty koagulačních faktorů (PPSB) atd. – mohou znovu nastartovat koagulaci. Nepodáváme nikdy pokud je nedostatečná koncentrace AT III[6].
Souhrnné video[upravit | editovat zdroj]
Odkazy
Související články[upravit | editovat zdroj]
Reference[upravit | editovat zdroj]
- ↑ LEVI, M, E DE JONGE a T MAYES. New treatment strategies for disseminated intravascular coagulation based on current understanding of the pathophysiology. Annals of Medicine. 2004, roč. 36, vol. 1, s. 41, ISSN 1365-2060.
- ↑ HEROLD, Gerd, et al. Herold Innere Medizin. 1. vydání. 2008. 895 s. s. 123-4. ISBN 3890197043.
- ↑ a b c MURRAY, Robert K, Daryl K GRANNER a Peter A MAYES, et al. The Harper´s Illustrated Biochemistry. 23. vydání. East Norwalk : Appelton & Lange, 1993. 872 s. s. 718. ISBN 80-7319-013-3.
- ↑ LEVI, M a E DE JONGE. Disseminated intravascular coagulation: What's new?. Critical Care Clinics. 2005, roč. 21, vol. 3, s. 67, ISSN 07490704.
- ↑ a b c LEBL, J, J JANDA a P POHUNEK, et al. Klinická pediatrie. 1. vydání. Galén, 2012. 698 s. s. 562-564. ISBN 978-80-7262-772-1.
- ↑ a b HECK, Michael a Michael FRESENIUS. Repetitorium Anästhesiologie. 5. vydání. Heidelberg : Springer, 2007. 642 s. ISBN 978-3-540-46575-1.
- ↑ BECKER, Joseph U. Disseminated Intravascular Coagulation [online]. Poslední revize 2009-09-10, [cit. 2010-05-13]. <https://emedicine.medscape.com/article/199627-overview,>.
- ↑ a b c BECKER, Joseph U a Charles R WIRA. Disseminated Intravascular Coagulation: Differential Diagnoses & Workup [online]. Poslední revize 10.9.2009, [cit. 2010-06-30]. <https://emedicine.medscape.com/article/199627-diagnosis>.
Použitá literatura[upravit | editovat zdroj]
- NEČAS, Emanuel, Karel ŠULC a Martin VOKURKA. Patologická fyziologie orgánových systémů. Část I. 1. vydání. Praha : Karolinum, 2007. ISBN 978-80-246-0615-6.