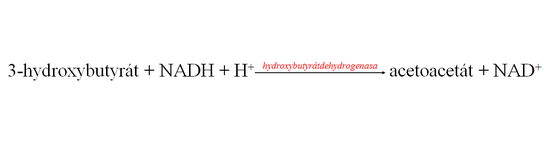Energetický metabolismus a jeho poruchy
Úvod[upravit | editovat zdroj]
Všechny procesy v živých buňkách probíhají za transformace energie. Energie chemické vazby mezi uhlíkem a uhlíkem (–C–C–) a mezi uhlíkem a vodíkem (–C–H–) je přeměňována ne jiné formy. Energetickou transformaci v buňkách z živin přijímaných z okolí můžeme rozdělit do 3 fází:
- získávání energie oxidací živin
- konverze této energie do biologicky využitelné formy vysoceenergetických fosfátových vazeb ATP
- utilizace energie fosfátových vazeb ATP pro pochody vyžadující energii
První dvě fáze transformace energie jsou součástí tzv. buněčné respirace (obr. 1). Buňka získává energii hlavně oxidační fosforylací, která se odehrává v respiračním řetězci v mitochondriích. Méně účinná, ale stejně důležitá je produkce energie v průběhu anaerobní glykolýzy. Mají-li být životní pochody v organismu zachovány, musí být tvorba adenosintrifosfátu (ATP), který je hlavním bezprostředním dodavatelem energie, vyvážena s jeho potřebou; není-li tomu tak, vzniká energetický deficit (obr. 2).
Poruchy energetického metabolismu[upravit | editovat zdroj]
Příčiny poruch energetického metabolismu můžeme rozdělit do tří velkých skupin:
- Poruchy způsobené nevyvážeností přívodu a výdeje energie (dlouhodobé hladovění, anorexia nervosa, malnutrice, marasmus, malabsorpce, přejídání)
- Poruchy v intermediárním metabolismu (endokrinopatie jako hyperthyreóza, esenciální obezita, nádorová kachexie, mnohočetná orgánová dysfunkce)
- Poruchy v buněčné respiraci (tkáňová hypoxie, látky způsobující rozpojení oxidace od fosforylace, otrava kyanidem nebo CO)
Příčiny se mohou pochopitelně kombinovat.
Vyšetření energetického potenciálu jaterní buňky[upravit | editovat zdroj]
Měření poměru NAD+/NADH (redox-potenciál) přímo v buňkách (mitochondriích) není možné. Ozawa (1983) přišel na způsob nepřímého měření intramitochondriálního redox-potenciálu na základě vzájemného poměru oxido-redukční reakce:
Podmínkou je měřit tento poměr v arteriální krvi a dále v nepřítomnosti stavů, kdy dochází k nadprodukci ketolátek (ketóza). Ozawa (1992) nazval toto vyšetření jako stanovení poměru ketolátek v arteriální krvi (AKBR – Arterial Ketone Body Ratio) a prokázal, že reflektuje intramitochondrální poměr NAD+/NADH a tím i ATP/ADP především v hepatocytech. Poškození jaterních buněk (nekróza) se všemi důsledky (deficit buněčné energie) a projevy poruch metabolických funkcí hepatocytu znázorňuje obr. 3.
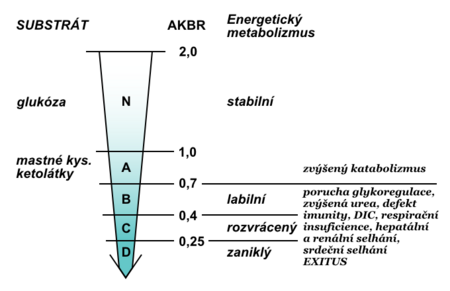
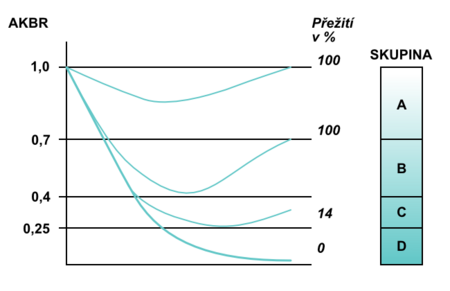
Při energetické vyrovnanosti hodnota AKBR je > 1,0 (nejvýše může být 2,0).U zdravých jedinců se docílí podáním 75 g glukosy per os nebo aplikací 15 g intravenózně. Ozawa nazval tuto hodnotu jako oxidační maximum (Oxi-Max). Získává-li organismus energii převážně oxidací mastných kyselin, AKBR se snižuje k hodnotě 0,7. Další pokles pod tuto hodnotu odráží postupný energetický deficit. Kritickou, ale ještě reverzibilní situací je pokles až k hodnotě 0,4; snížení pod 0,25 je už s životem neslučitelné (obr. 4). Sledování trendu AKBR může být objektivním prognostickým ukazatelem klinického stavu kriticky nemocných (obr. 5).
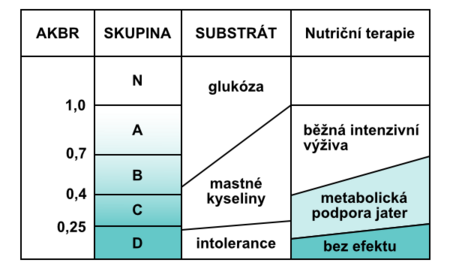
Při poklesu AKBR pod 0,4 dochází ke kompletní inhibici glukoneogeneze, k výraznému vzestupu laktátu, ke snížení poměru cytoplasmatického NAD+/NADH, začíná pokles i mitochondriálního NAD+/NADH mnohočetná orgánová dysfunkce. V laboratorním vyšetření nalézáme projevy intolerance glukosy (hyperglykemii při exogenním podání) nereagující ani na současnou aplikaci insulinu, sníženou hladinu větvených aminokyselin, patologický Fisherův index, zvýšený katabolický index, negativní bilanci dusíku, patologickou diferenci mezi vypočtenou a naměřenou hodnotou osmolality, bilirubinemii, zvýšení AST, ALT, hyperamonemii, zvýšení kreatininu a LD, pozitivní testy pro přítomnost diseminované intravaskulární koagulopatie (antithrombin III, Quickův test, aPTT, faktor II, V, VII, IX, X, antiplasmin), pozitivní testy svědčící pro poruchu imunity, snížení proteosyntézy (nízký prealbumin. albumin, transferin). Hodnota AKBR je velmi užitečná též pro správné vedení nutriční terapie u kriticky nemocných. Informuje totiž o tom, který substrát je především využíván buňkami pro krytí potřebné energie (obr. 6).
Nejdůležitější klinické situace, při nichž je vhodné vyšetřovat hodnotu AKBR:
- včasné rozpoznání hrozící multiorgánové dysfunkce,
- monitorování těžkých zákroků na játrech (resekce, transplantace),
- sledování kriticky nemocných (hemoragický šok, abdominální sepse, polytraumata),
- monitorování adekvátnosti umělé výživy.
Energetická bilance[upravit | editovat zdroj]
Příjem a výdej energie v organismu musí být vyvážený, aby nedošlo k přírůstku nebo úbytku na tělesné hmotnosti. Energetický obsah potravy a energetické zásoby člověka shrnuje tabulka:
| složka | Energetický obsah (kcal/g) | ukládá se do tkáně | procentuální zastoupení v dané tkáni | hmotnost |
|---|---|---|---|---|
| Sacharidy | 4 | Jaterní glykogen | 0,2 % | 0,08 kg |
| Svalový glykogen | 0,4 % | 0,15 kg | ||
| Proteiny | 4 | Proteiny (nejsou pravou zásobou) | 14,5 % | 6 kg |
| Lipidy | 9 | Tuk | 85 % | 15 kg |
| Alkohol | 7 |
Bazální metabolický obrat (BMR) je míra energie potřebná k udržení základních životních funkcí v klidu na lůžku. V průměru to je 24 kcal/den/kg tělesné hmotnosti (kupř. u 70 kg člověka 24 × 70 = 1680). Podrobnější výpočet umožní:
- Harris–Benedictův vzorec
- BMR ženy = 655 + (9,6 × hmotnost v kg) + (1,8 × výška v cm) − (4,7 × věk v rocích)
- BMR muži = 66 + (13,7 × hmotnost) + (5 × výška) − (6,8 × věk)
- Owenův vzorec
- BMR ženy = 795 + (7,18 × hmotnost)
- BMR muži = 879 + (10,2 × hmotnost)
Při zvýšení fyzické aktivity je nutno tuto bazální potřebu (výdej) energie násobit faktorem aktivity:
| Stupeň aktivity | faktor aktivity/hodina | přepočteno na kcal | |
|---|---|---|---|
| Klid | spánek, klid na lůžku | 1,0 | 1680 |
| Velmi mírná | aktivita vsedě a vestoje, řízení auta, administrativní práce, vaření, hraní v karty, muzicírování | 1,5 | 2520 |
| Mírná | chůze s výkonem 4–4,8 km/h, práce v garáži, v restauraci, úklid domu, golf, stolní tenis | 2,5 | 4200 |
| Střední | chůze s výkonem 5,6–6,4 km/h, nošení nákladů, jízda na kole, lyžování, tenis, tanec | 5,0 | 8400 |
| Těžká | chůze do kopce s nákladem, kácení stromů, horolezectví, těžká manuální práce, košíková, fotbal, hokej | 7,0 | 11 760 |
Poruchy z nedostatku kyslíku[upravit | editovat zdroj]
Při nedostatku kyslíku v mitochondriích je znemožněna regenerace ATP z ADP oxidativní fosforylací jako hlavní zdroj energie pro aerobní organismy. Anaerobní glykolýza, která se snaží pokrýt nejnutnější požadavky buněčné energie, vystačí jen velmi krátkou dobu (za normálních okolností několik málo desítek sekund až několik minut). Nahromadění konečného metabolitu anaerobní glykolýzy – laktátu – zvýší po vyčerpání všech regulačních mechanismů koncentraci protonů (H+) natolik, že dojde k zablokování buněčného metabolismu, končícího buněčnou smrtí (ne všechny tkáně jsou postiženy stejně rychle). Porozumění základním mechanismům, kterými se řídí stav kyslíku v organismu je velmi důležité pro správnou diagnózu a tím i adekvátní léčbu (zejména pacientů v kritickém stavu s nedostatečným přísunem kyslíku pro buněčný energetický metabolismus). Kritický přísun kyslíku (critical oxygen delivery) závisí dle Siggaard–Andersena na příčině nízkého přísunu. Kupř. je-li přísun kyslíku poloviční a je to způsobeno snížením minutového srdečního objemu na polovinu, pak parciální tlak kyslíku (pO2) ve smíšené venózní krvi klesne asi na hodnotu 3,5 kPa. Je-li to však způsobeno polovičním snížením koncentrace celkového kyslíku v arteriální krvi, pak pO2 ve smíšené venózní krvi klesne asi na 2,2 kPa. Tenze kyslíku ve smíšené venózní krvi velmi úzce souvisí s průměrnou tenzí O2 na konci kapilárního řečiště, která předurčuje difúzní gradient pro O2 z erytrocytů do mitochondrií. Z tohoto důvodu má údaj o kritické hodnotě pO2 ve smíšené venózní krvi větší výpovědní hodnotu než kritický přívod kyslíku.
Patobiochemie metabolismu O2[upravit | editovat zdroj]
Oxidační metabolismus u člověka je ovlivňován třemi základními faktory:
- Konvekčním transportem O2 z okolního vzduchu do krevních kapilár příslušných tkání za pomoci hemoglobinu a erytrocytů jako vehikula;
- Difúzí O2 z erytrocytů v kapilárách do mitochondrií buněk;
- Redukcí kyslíku v mitochondriích prostřednictvím transportů elektronů z reduktantů, tj. sacharidů, tuků nebo proteinů (transportní řetěz elektronů sestávající z cytochromů, flavoproteinů a nikotinamidnukleotidů).
Vedení kyslíku (oxygen convection)[upravit | editovat zdroj]
Látková změna (substance rate) vedení kyslíku krevním proudem, tj. přívod kyslíku (nO2 flow) je produkt minutového srdečního objemu (V.B flow) a koncentrace celkového kyslíku v arteriální krvi (ctO2A):
Látková změna extrakce kyslíku z krve (n.O2 extr) je produkt srdečního minutového objemu a arteriovenózního rozdílu koncentrace celkového kyslíku:
Difúze kyslíku[upravit | editovat zdroj]
Látková změna difúze kyslíku z hemoglobinu na cytochromoxidasu, tj. cytochrom aa3 (n.O2 diff) může být vypočtena jako produkt difúzního koeficientu (δO2), koeficientu rozpustnosti O2 (αO2), celkové difúzní plochy endotelu kapilár (A) a gradientu tenze kyslíku (dpO2/dl):
Produkt difúzního koeficientu a koeficientu rozpustnosti je koeficient permeability (kappa O2). Poměr mezi plochou difúze a difúzní drahou narůstá ve svalu při aktivitě (práci) vzrůstem počtu průtočných kapilár. Tento poměr klesá, dojde-li k edematóznímu prosáknutí tkáně nebo při mikroembolizaci. Gradient tenze kyslíku je rozdíl středních tenzí kyslíku (pO2 cap − pO2 cell) dělený střední vzdáleností mezi erytrocyty a mitochondriemi. Limitujícím faktorem difúze kyslíku je tenze O2 na konci kapilárního řečiště.
Tenze kyslíku smíšené venózní krve se většinou rovná tenzi O2 na konci kapiláry; je však přitom třeba brát v úvahu A–V zkraty. Když kupř. vzrostou arterio-venózní zkraty v kůži nebo jinde o 10 % z celkového srdečního minutového objemu, pak tenze O2 smíšené venózní krve je asi o 0,3 kPa vyšší než střední tenze O2 na konci kapilár.
Redukce kyslíku[upravit | editovat zdroj]
Redukce O2 v mitochondriích probíhá jako reakce nultého řádu, která odvisí spíše na požadavcích energie než na dostupnosti kyslíku. Hyperbazický kyslík, kupříkladu, nezvyšuje spotřebu kyslíku. Jinými slovy velikost difúze kyslíku (n.O2 diff) a velikost extrakce kyslíku (N.O2 extr) se vzájemně nastaví tak, aby to odpovídalo velikosti redukce kyslíku (n.O2 red). Tato je regulována poměrem ATP/ADP. Více než 90 % redukce kyslíku se děje v mitochondriích, kde při redukci jedné molekuly O2 dojde při oxidační fosforylaci k obnově šesti molekul ATP z ADP. V některých tkáních, jako je hnědý tuk u některých savců, je redukce kyslíku sdružena pouze s produkcí tepla bez vzniku ATP. Některá toxická agens nebo léky rozpojují oxidativní fosforylaci a ATP při redukci O2 nevzniká. Množství energie vznikající při redukci O2 činí asi 450 kJ/mol; závisí to na povaze metabolizovaného zdroje (sacharidy, tuky nebo proteiny). Užitečná chemická energie při hydrolýze ATP činí asi 50 kJ/mol. Redukce O2 začne probíhat podle reakční kinetiky prvního řádu podle koncentrace pO2 v buněčném cytosolu, jakmile jeho hodnota poklesne o 0,1 kPa pod kritickou hranici. Normální průměrná tenze O2 v buňce činí 1,6 kPa s variacemi podle druhu tkáně. Toxická inhibice cytochromů zvyšuje kritickou hodnotu buněčného pO2. Otrava kyanidem může blokovat redukci kyslíku úplně.
Normální průměrná hodnota pO2 na konci kapilárního řečiště je asi 5,0 kPa. Průměrný rozdíl mezi pO2 v erytrocytech a v mitochondriích je asi 3,4 kPa. Dýchání vyššího obsahu kyslíku zvyšuje pO2 na konci kapiláry stejně jako v buňce, takže rozdíl a rychlost difúze zůstávají stejné. Když poklesne pO2 na konci kapiláry kupř. pro pokles arteriálního pO2, buněčný pO2 poklesne o stejnou hodnotu a také difúzní tok zůstávají nezměněny až do okamžiku, kdy hodnota pO2 na konci kapiláry dosáhne kritické hodnoty, t.j. 3,5 kPa a buněčné pO2 klesne na hodnotu 0,1 kPa. Pokračující pokles pO2 na konci kapiláry způsobí snižování redukce O2 v mitochondriích. Když kupř. pO2 na konci kapiláry klesne na 1,7 kPa, pak buněčné pO2 poklesne na hodnotu 0,05 kPa; rychlost difúze O2 je pak poloviční, což předurčuje rychlost redukce O2, která je také poloviční.
Vztah mezi rychlostí redukce kyslíku a pO2 ve smíšené venózní krvi[upravit | editovat zdroj]
Primární změny v pO2 smíšené venózní krve[upravit | editovat zdroj]
Když venózní pO2 stoupá, kupř. při inhalaci bohaté na O2, rychlost spotřeby O2 zůstává konstantní. Je-li však vzestup venózního pO2 způsoben zvýšením srdečního minutového objemu, rychlost spotřeby O2 narůstá pro zvýšenou práci srdce. Když venózní pO2 klesá, zůstává rychlost spotřeby O2 většinou nezměněna, dokud není docíleno kritické hodnoty (3,5 kPa). Další snižování vede k poklesu spotřeby O2.
Při normálním stavu kyslíku a normální spotřebě O2, zdvojení srdečního minutového objemu zvýší pO2 ve smíšené venózní krvi z 5,0 kPa na 6,6 kPa; klesne-li srdeční minutový objem na polovinu, pO2 klesne na hodnotu kolem 3,5 kPa. Změna v extrakci kyslíku z arteriální krve způsobuje stejnou změnu v pO2 smíšené venózní krve, a tedy když rozdíl v arterio-venózní koncentraci O2 dostane hodnotu 2,3 mmol/l, pO2 ve smíšené venózní krvi se prakticky rovná extrakční tenzi arteriálního kyslíku.
Změny v poměru mezi plochou průměrné difúze kyslíku a difúzní vzdáleností[upravit | editovat zdroj]
Kritická hodnota pO2 smíšené venózní krve a křivka závislosti spotřeby kyslíku odvisí od poměru difúzní plocha/difúzní vzdálenost. Zvýšený poměr způsobený zvýšením počtu průtočných kapilár posunuje křivku spotřeby doleva (viz nomogram) a současně snižuje kritickou hodnotu smíšeného venózního pO2. Snížení tohoto poměru posunuje křivku doprava a zvyšuje kritickou hodnotu pvO2. Také zvýšení procenta arterio-venózních zkratů posunuje křivku doprava.
Patologické stavy v metabolismu kyslíku[upravit | editovat zdroj]
Nedostatek kyslíku v tkáních – tkáňová hypoxie – by měl být včas rozpoznán, správně klasifikován a pokud možno kvantifikován. Tkáňovou hypoxii se rozumí situace, kde tvorba oxidační energie je nedostatečná, kdy nastupuje produkce energie z anaerobní glykolýzy ve zvýšené míře, což způsobuje laktátovou acidózu a tím poruchy v buněčném metabolismu.
Příčiny tkáňové hypoxie[upravit | editovat zdroj]
Podle Siggaard-Andersena lze příčiny hypoxie rozdělit do osmi skupin:
- Snížení srdečního minutového objemu (V.B) způsobuje ischemickou hypoxii.
- Snížení kyslíkové tenze (px) způsobuje hypoxii z nízké extraktivity.
- Zvýšené arterio-venózní zkraty (fav–) (=zkratová hypoxie).
- Zvýšení střední dráhy difúze kyslíku (l diffus) (=dysperfúzní hypoxie).
- Snížení difúzní plochy v endotelu kapilár pro O2 (A diffus) (=dysperfúzní hypoxie).
- Inhibice cytochromů toxickými látkami (cyt. inhib.) (=histotoxická hypoxie).
- Snížený poměr mezi tvorbou ATP a redukce O2 (=hypoxie z rozpojení oxidativní fosforylace).
- Zvýšení energetického metabolismu (hypermetabolická hypoxie).
Příčiny nízkého px (skupina 2) jsou:
- nízké arteriální pO2 (= hypoxemická hypoxie),
- nízká efektivní koncentrace hemoglobinu (= anemická hypoxie),
- nízké p50 (= hypoxie z vysoké afinity Hemoglobinu pro O2),
Poznámka: Kvantitativní měření těchto příčin hypoxie je možné pouze u prvních dvou tj. měření minutového srdečního objemu a extrakční tenze kyslíku v arteriální krvi. Ostatní příčiny musí být hodnoceny klinicky.
Třídy tkáňové hypoxie[upravit | editovat zdroj]
Na základě účinku výše zmíněných faktorů na hodnotu pO2 v- smíšené venózní krve a na rychlost spotřeby kyslíku, je možno oněch 8 příčin hypoxie klasifikovat do 3 tříd.
- Třída A
Primární poruchou je snížení pO2 ve smíšené venózní krvi beze změn v optimální rychlosti spotřeby kyslíku. Když pO2 klesne pod kritickou hodnotu, klesá též rychlost spotřeby O2, což vede ke zvýšení anaerobní glykolýzy a tím k laktátové acidóze. Příčinou může být nízký minutový objem srdeční anebo nízká extrakční tenze kyslíku. Nízká hodnota jedné z těchto komponent může být kompenzována příslušnou změnou v druhé složce. Terapeutickým cílem je zvýšit pO2 v- nad kritickou hodnotu, aby byla zajištěna optimální rychlost spotřeby kyslíku.
- Třída B
Primární poruchou je navýšení kritické hodnoty pO2 ve smíšené venózní krvi, aniž by došlo ke změně v optimální spotřebě O2. Když kritická hodnota smíšeného venózního pO2 vzroste nad normální hodnotu (tj. 5 kPa), rychlost spotřeby kyslíku klesne a smíšený venózní pO2 stoupne aniž by vzrostl srdeční minutový objem anebo extrakční tenze kyslíku (jako kompenzační mechanismus). Pokles změny spotřeby kyslíku pod optimální hranici vyústí v anaerobní glykolýzu s následnou laktátovou acidózou. Příčinou hypoxie třídy B je "dysperfuze" způsobená zvýšením arterio–venózních zkratů, intersticiálním edémem s nárůstem difúzní vzdálenosti potřebné pro přenos kyslíku z hemoglobinu do mitochondrií a snížení celkové difúzní plochy endotelu kapilár. Histotoxická hypoxie způsobená inhibicí cytochromů může rovněž způsobit primární zvýšení kritické hodnoty pO2 ve smíšené venózní krvi, protože se zvyšuje kritické pO2 buňky. Terapeutickým cílem, kromě kauzální terapie, je zvýšení smíšeného venózního pO2 na supra-normální hodnotu.
- Třída C
Primární poruchou je zvýšení bazálních požadavků na kyslík se sekundárním vzestupem kritické hodnoty pO2 ve smíšené venózní krvi. Je-li minutový srdeční objem nezměněn, smíšené venózní pO2 klesá jako důsledek vzestupu spotřeby kyslíku. Příčinou hypoxie třídy C je zvýšený metabolismus způsobený rozpojením oxidativní fosforylace ATP a zvýšením potřeby ATP. Terapeutickým cílem je zvýšení smíšeného venózního pO2 na supra-normální hodnotu, aby byl zajištěn difúzní tok kyslíku souběžně se zvýšenou spotřebou O2.
| TŘÍDA | |||||
| optimální změna spotřeby O2 | kritické smíšené venózní pO2 | aktuální smíšené venózní pO2 | Typ hypoxie | Primární porucha | |
| A | normální | normální | snížené | ischemická | klesá V.B |
| nízká extraktivita | klesá px | ||||
| hypoxemická | klesá pO2 | ||||
| anemická | klesá koncentrace Hemoglobinu | ||||
| z vysoké afinity | klesá p50 | ||||
| B | normální | zvýšené | zvýšené | zkratová | stoupá fav– |
| dysperfúzní | stoupá l diffus a A diffus | ||||
| histotoxická | inhibice cytochromů | ||||
| C | zvýšené | zvýšené | snížené | rozpojení oxidativní fosforylace | klesá množství ATP |
| hypermetabolická | |||||
Odkazy[upravit | editovat zdroj]
Související články[upravit | editovat zdroj]
| Další kapitoly z knihy MASOPUST, J., PRŮŠA, R.: Patobiochemie metabolických drah: | |
|
Zdroj[upravit | editovat zdroj]
- MASOPUST, Jaroslav a Richard PRŮŠA. Patobiochemie metabolických drah. 2. vydání. Univerzita Karlova, 2004. 208 s.