Enzymy (1. LF VL, Lékařská chemie a biochemie 1. paralelka)
Enzymy jsou bílkoviny s biokatalytickou funkcí. Jsou nástrojem exprese genů. Výsledkem jejich působení v organismu je látková přeměna (intermediární metabolismus), která je projevem rovnováhy dějů anabolických a katabolických.
V katabolických získává organismus energii pro mechanickou či osmotickou práci, ale také pro děje anabolické (např. syntéza dalších prekurzorů, makromolekulárních látek, mediátorů a hormonů, nezbytných pro životní funkce a jejich regulace). Spřaženými enzymovými reakcemi jsou překonávány nevýhodné metabolické kroky (spojení reakcí endergonických s exergonickými).
- Látky, které se působením enzymů mění, se nazývají substráty.
- Hlavními rysy biokatalýzy jsou zejména značná katalytická účinnost a větší či menší specifičnost vůči typu substrátu i vzhledem k typu katalyzované reakce.
- Z bílkovinné povahy enzymu a jeho specifické interakce se substrátem za tvorby enzym-substrátového komplexu plynou i další vlastnosti enzymových systémů, jako je ovlivnění faktory fyzikální a chemické povahy. Vliv zde mají:
- teplota
- pH prostředí
- ionty jako aktivátory apod.
- inhibitory (kompetitivní nebo nekompetitivní)
- efektory allosterické povahy
Rozdělení enzymů
Enzymy se dělí na sedm hlavních tříd podle typu reakce, kterou katalyzují.
- Oxidoreduktázy – dehydrogenázy, oxidázy, peroxidázy, oxygenázy
- Transferasy – aminotransferasy, kinázy
- Hydrolasy – peptidasy, glykosidasy, fosfatasy
- Lyasy – synthasy, dekarboxylasy
- Isomerasy
- Ligasy – synthetasy
- Translokasy
Využití afinitní chromatografie
Specifické interakce enzymu se substrátem, substrátovým analogem či inhibitorem lze využít i při izolaci enzymu. Enzym jako bílkovinu lze ovšem izolovat postupy běžnými v biochemii bílkovin. V poslední době se s výhodou využívá afinitní chromatografie.
- Tato metoda využívá specifičnosti biologických interakcí typu: enzym-substrát, enzym-substrátové analogy nebo enzym-inhibitor.
- Existují i jiné možnosti specifických interakcí, např. typu antigen-protilátka, hormon-nosič (receptor) apod.
Afinitní chromatografie je zvláštním případem adsorpční chromatografie, při níž má adsorbent specifickou afinitu k látkám, které mají být izolovány.
- Při izolaci enzymu se naváže inhibitor nebo substrátový analog na vhodný nosič (např. Sepharosa®., což je agarosový gel připravený ve formě kulovitých částic). Taková navázaná skupina se specifickou afinitou se nazývá ligand (afinant).
- Často je nutné oddálit afinant od vlastního nosiče prostřednictvím tzv. raménka (spacer), aby nedocházelo ke sterickým zábranám při přístupu velké molekuly enzymu (bílkoviny) k malé molekule navázaného ligandu.
- Vazba enzymu na ligand je vratné povahy a tuto vratnou vazbu lze rozrušit změnou fyzikálně-chemických vlastností promývací tekutiny, např. změnou pH, iontové síly nebo také nadbytkem volného substrátu či substrátového analogu, který vytěsní ligand z vazby na enzym.
Mechanismus účinku enzymů
Enzymy pracují na principu snížení aktivační energie. Dochází k tvorbě komplexu enzym-substrát (E-S), pak ku komplexu enzym-produkt (E-P), který se rozpadá za uvolnění produktu.
Fyzikálně-chemické vlivy působící na činnost enzymů
Vliv teploty
Většina chemických reakcí závisí na teplotě a reakce katalyzované enzymy v tom nejsou výjimkou.
- Podle kinetické teorie vykládáme vzrůst rychlosti reakce s teplotou až do dosažení optimální teploty zvýšenou kinetickou energií reagujících molekul, což přispívá také ke tvorbě enzym-substrátového komplexu.
- Teplotní koeficient Q10 je poměr, kolikrát se rychlost chemické reakce změní se vzrůstem teploty o 10 °C. U většiny chemických reakcí činí tento poměr asi 2, ale pro některé fyziologické pochody, katalyzované enzymy, je vyšší.
- Pro většinu enzymů je optimální teplota zhruba shodná s teplotou, která existuje v prostředí buňky, a pro teplokrevné (homoiotermní) organismy, k nimž patří člověk, činí 37 °C.
- Pro některé baktérie, žijící v extrémních podmínkách, může optimální teplota (ale i optimální pH a optimální iontové složení) dosahovat značně extrémních hodnot. Např. některé mikroorganismy žijící v horkých přírodních pramenech mají optimální teplotu pro své enzymy blízkou bodu varu vody. U savčích enzymů však takové teploty leží již za optimální teplotou. V takových podmínkách je kinetická energie enzymových molekul tak velká, že překročí energetickou bariéru pro rozrušení sekundárních vazeb a interakcí, udržujících enzymovou molekulu v té konformaci (sekundární a terciární struktuře), která je pro enzymovou katalýzu nezbytná. Tím nastává denaturace provázená úbytkem až i ztrátou enzymové aktivity.
- Test tepelné lability
(ale i lability vůči pH) patří k jednoduchým kritériím, zda daná reakce je enzymy katalyzována.
- U většiny savčích enzymů se tepelně denaturují enzymy již při 60 až 80 °C. Povařením se enzymy denaturují většinou velmi rychle.
- Závislost enzymové aktivity na vzrůstající teplotě lze vyjádřit graficky zvonovitou křivkou, která má vrchol u optimální teploty.
Závislost enzymové aktivity na pH
Závislost enzymové aktivity na pH je jiným významným činitelem, ovlivňujícím aktivitu enzymů. Také tuto závislost lze vyjádřit graficky zvonovitou křivkou s vrcholem u optimálního pH, které u většiny enzymů leží v rozmezí 5,0 až 9,0.
- Některé enzymy jsou však výjimkou, např. pepsin, působící v silně kyselém prostředí žaludeční šťávy, má optimální pH mezi 1,5 až 2,0.
- Vliv pH na vzrůst enzymové aktivity až do dosažení optimálního pH lze vyložit ovlivněním disociace ionizovatelných funkčních skupin substrátu i enzymu, které odpovídají za interakci enzymu se substrátem při tvorbě enzym-substrátového komplexu, ale i za udržování konformace enzymu. Krom toho se některé ionizovatelné funkční skupiny v aktivním centru podílejí na acidobazické katalýze. Protože enzymy jsou bílkovinné povahy, jsou stálé jako amfolyty jen v určitém rozmezí hodnot pH blízkém neutralitě.
- Extrémně kyselé nebo alkalické roztoky enzymy denaturují opět změnou konformace. To je podmíněné rozrušením sekundárních vazeb a interakcí, někdy i rozpadem kvartérní struktury na podjednotky nebo disociací nebílkovinné složky enzymu.
Vliv iontů na enzymy
Vliv iontů na enzymy je nejlépe patrný u některých dvojmocných kationtů (např. Ca2+, Mg2+, Zn2+) jako aktivátorů. Tyto ionty mohou vytvářet komplex se substrátem za tvorby metalosubstrátového komplexu, nebo komplex s enzymem, který pak váže substrát ve formě enzym-metalo-substrátového komplexu.
- Kovové ionty mohou měnit také rovnovážné stavy, ať už odstraňováním produktů ve formě komplexu s produktem reakce, nebo zvýšenou nabídkou substrátu, je-li účinnou formou metalo-substrátový komplex.
- Jindy mohou kovy ovlivnit konformaci enzymového proteinu, udržovat kvartérní strukturu enzymu nebo mohou působit jako inhibitory vazbou na účinné skupiny aktivního centra (např. -SH skupiny jsou blokovány ionty Hg2+).
- Některé kovové ionty se mohou podílet na mechanismu enzymově katalytické reakce interakcí se substrátem jako tzv. Lewisovy kyseliny (akceptory elektronových párů).
- Fluoridové ionty mohou zase působit inhibičně vazbou kationtů jako aktivátorů, např. vazbou Ca2+ nebo Mg2+.
- Přítomnost solí může také nespecificky ovlivňovat aktivitu enzymu změnou iontové síly (např. ionty Cl-), a tím působit na hydrataci enzymového proteinu nebo na elektrokinetický potenciál, který mění pevnost iontových (elektrostatických) vazeb v molekule enzymu.
Stanovení enzymové aktivity
Enzymy jsou v biologickém materiálu obsaženy ve velmi nízkých koncentracích. Pro popis biochemických dějů je navíc užitečnější znát jejich účinnost spíše než samotné množství enzymu. Namísto měření koncentrace enzymu se proto většinou s výhodou využívá substrátové specifičnosti enzymů a jejich značné katalytické účinnosti při měření aktivity enzymu. Množství enzymu tedy kvantifikujeme nepřímo na základě rychlosti, jakou enzym katalyzuje přeměnu substrátu na produkt ve zvoleném časovém intervalu. Tato metoda je dostatečně specifická za předpokladu, že na substrát působí v daném materiálu jen jeden enzym. Je i dostatečně citlivá a přesná, je-li zvolena vhodná koncentrace substrátu vzhledem k enzymu a vhodná metoda stanovení úbytku substrátu nebo přírůstku produktu v čase, neboli vhodná metoda stanovení rychlosti přeměny substrátu na produkt.
Enzymová aktivita
Abychom mohli snadno porovnávat rychlost úbytku substrátu nebo přírůstku produktu v různých časových intervalech, je účelné, aby tyto rychlosti byly v čase konstantní, tj. aby reakce probíhala podle kinetiky nultého řádu. Toho lze dosáhnout, přísně vzato, jen tehdy, je-li veškerý enzym substrátem nasycen, tj. když je veškerý enzym o celkové koncentraci [E]t vázán v formě enzym-substrátovém komplexu ES. Taková situace nastává jen při velkém nadbytku substrátu. Pak probíhá enzymová reakce s maximální rychlostí Vmax. Za této situace můžeme snadno definovat i jednotky enzymové aktivity, protože zdvojnásobíme-li koncentraci enzymu, vzroste dvojnásobně i maximální rychlost Vmax apod.
Za podmínky, že enzym pracuje v prostředí se značným nadbytkem substrátu, můžeme tedy kineticky vyjádřit množství enzymu [E]t jako rychlost Vmax. Jako jednotka množství enzymu, správněji množství enzymové aktivity, slouží katal (1 kat). Je to takové množství enzymové aktivity, které katalyzuje přeměnu 1 molu substrátu za sekundu. Pro praxi je tato jednotka hodně velká, proto většinou pracujeme s jejími zlomky – mikrokataly (1 μkat = 10−6 kat), nanokataly (1 nkat = 10−9 kat) a pikokataly (1 pkat = 10−12 kat)
Převod enzymových jednotek (U) na kataly (kat) se řídí vztahem:
- 1 U = 1 μmol/min = 1/60 μmol/s = 1/60 μkat = 16,67 nkat .
V předchozím textu jsme předpokládali, že rychlost enzymové reakce sledujeme při maximálním nasycení enzymu substrátem (kinetika nultého řádu), tedy při dosažení maximální rychlosti Vmax. Za těchto podmínek je Vmax úměrná koncentraci enzymu. Kinetiky nultého řádu lze však aproximativně využít i tehdy, jestliže enzym substrátem nasycen není, tj. i při menších koncentracích substrátu. Je to však možné jen tehdy, pokud se v průběhu měření koncentrace substrátu [S] příliš nemění – tj. příliš se nesnižuje oproti počáteční koncentraci substrátu [S]0. Tato podmínka je naplněna, sledujeme-li průběh reakce jen v prvních minutách, kdy je úbytek koncentrace substrátu menší než zhruba jedna desetina původní hodnoty. Rychlost reakce v této fázi označujeme jako počáteční rychlost v0. Rovněž koncentraci enzym-substrátového komplexu [ES] můžeme v této fázi pokládat za stálou (steady-state). Při větším úbytku substrátu (poklesu koncentrace [S]) ovšem koncentrace [ES] klesá, takže kinetika nultého řádu přechází do kinetiky prvého, druhého i vyššího řádu.
Michaelisova konstanta
Pomocí iniciální rychlosti v0 lze sledovat pro určité předpokládané množství enzymové aktivity vztah této rychlosti v0 k určité výchozí koncentraci substrátu [S]0. Můžeme se tedy zabývat chováním enzymové reakce v situacích, kdy není dosaženo maximální rychlosti Vmax pro celkovou koncentraci enzymu [E]t. U téhož enzymu může být ovšem pojem vysoké a nízké koncentrace substrátu relativní – může totiž záviset na konkrétním typu substrátu a na tom, jakou má enzym k tomuto substrátu afinitu. Využíváme proto veličinu, která je pro danou dvojici enzym-substrát charakteristickou konstantou. Je to tzv. Michaelisova konstanta (Km), která označuje takovou látkovou koncentraci substrátu, při níž je rychlost enzymové reakce (v) polovinou rychlosti maximální (Vmax).
Michaelis a Mentenová odvodili vztah mezi Km, [S], v a Vmax:
Nízká hodnota Km značí velkou afinitu enzymu k substrátu. Vedle toho, že Km charakterizuje danou dvojici enzym-substrát, je sledování Km nezbytné též k odlišení mechanismu inhibice (nejčastěji typu kompetitivního nebo nekompetitivního).
Stanovení Michaelisovy konstanty
Počáteční rychlost enzymové reakce se snáze měří pro nízké počáteční koncentrace substrátu [S]0; při vysokých koncentracích substrátu je reakční rychlost vysoká, substrát se rychle spotřebovává a reakční rychlost se tak podstatně mění během krátké doby od zahájení reakce. Ovšem vyneseme-li do grafu reakční rychlosti v proti počátečním koncentracím substrátu [S]0, je obtížné přímo z tohoto grafu určit parametry Vmax a Km, máme-li k dispozici jen měření při nízkých koncentracích substrátu. Vzniklo proto několik postupů, jak tyto parametry určit.
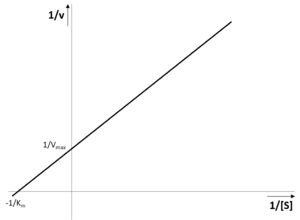
Mezi nejčastěji zmiňované grafické metody patří transformace dat podle Lineweavera a Burka. Hyperbolickou závislost rychlosti v na koncentraci substrátu [S]
můžeme snadno transformovat na lineární funkci – převrácená hodnota rychlosti 1/v totiž lineárně závisí na převrácené hodnotě koncentrace substrátu 1/[S]:
Vynášíme-li 1/v na na svislou osu a 1/[S] na vodorovnou osu, budou za podmínek kinetiky 2. řádu naměřená data ležet v přímce. Tato přímka protíná svislou osu v hodnotě 1/Vmax a vodorovnou osu v hodnotě −1/Km.
Metoda podle Lineweavera a Burka je bohužel citlivá i na relativně malé chyby měření při nízkých koncentracích substrátu. Přesnější grafickou metodou pro stanovení parametrů Vmax a Km je metoda podle Eisenthala a Cornishe-Bowdena. Postupuje se při ní takto:
- Pro několik koncentrací substrátu [S] naměříme experimentálně reakční rychlosti v. Tyto hodnoty vyneseme do grafu jako závislost v na [S].
- Pro každý vynesený bod vyznačíme hodnotu [S] na vodorovné ose (bod A) a hodnotu v na svislé ose (bod B). Sestrojíme přímku, která prochází body A a B.
- Z polohy průsečíku takto sestrojených přímek lze odečíst hodnoty Km a Vmax (průsečík má souřadnice [−Km, Vmax]).
Jinou grafickou metodou je vynesení podle Eadie-Hofsteeho. Vynáší se v na svislé ose proti v/[S] na vodorovné ose a body se proloží přímkou. Vmax se vyhledá jako průsečík této přímky se svislou osou, Vmax/Km je průsečík s vodorovnou osou a směrnice přímky je −Km.
Grafické metody jsou sice ilustrativní, v současnosti se ovšem kinetické parametry počítají metodami nelineární regrese.
Odkazy
Použitá literatura
MATOUŠ, Bohuslav, et al. Základy lékařské chemie a biochemie. 1. vydání. Praha : Galén, 2010. 540 s. ISBN 978-80-7262-702-8.



![{\displaystyle v={\frac {V_{max}\cdot [S]}{K_{m}+[S]}}={\frac {V_{max}}{1+{\frac {K_{m}}{[S]}}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/9424b4e5f247badad335f81a11af50d7897741c2)
![{\displaystyle v={\frac {V_{max}\cdot [S]}{K_{m}+[S]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/8eda6aa5aa3359bda1809e8612cbc3069bc1320b)
![{\displaystyle {1 \over v}={\frac {K_{m}+[S]}{V_{max}\cdot [S]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/b40da210920ab7e4c220175e5110c188b4c84151)
![{\displaystyle {1 \over v}={K_{m} \over V_{max}}\cdot {1 \over [S]}+{1 \over V_{max}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/904a5028d9114b19392bb710c040ce286b6dfe61)
