Fluorescence
Úvod[upravit | editovat zdroj]
Fluorescence je fyzikálně chemický děj, který je typem luminiscence. Luminiscence se dále dělí na elektroluminiscenci, fotoluminiscenci, radioluminiscenci a chemiluminiscenci. Fluorescence patří mezi fotoluminiscenční záření, které je vyvoláno buď účinkem jiného dopadajícího záření, nebo účinkem dopadajících částic.
Původ jevu[upravit | editovat zdroj]
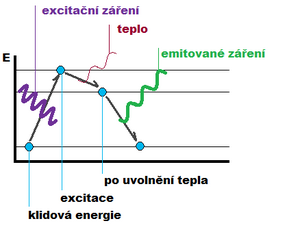
Původ luminiscenčního záření je v atomech popřípadě v molekulách látek. Model atomu byl navržen již v roce 1911 anglickým fyzikem Ernestem Rutherfordem. Tento model byl dále upravován a upřesňován dalšími fyziky. Pro pochopení fluorescence je postačující představa modelu atomu dánského fyzika Nielse Bohra, který se domníval, že elektrony obíhají jen po určitých drahách - orbitalech. Každý orbital představuje určitou hladinu energie potřebnou pro udržení elektronu v obalu. Čím je orbital vzdálenější, tím více energie na udržení je potřeba a naopak tím menší energie je potřeba na jeho odtržení. K vlastní luminiscenci dochází prakticky jen pokud se atom nachází ve vybuzeném stavu (excitace). Jedná se o stav, kdy dochází k absorpci energie dopadajícího záření nebo dopadajících elektronů. Energie atomu se následně zvyšuje, jelikož obíhající elektrony přecházejí do vzdálenějších orbitalů. Na základě kvantového modelu atomu nemůže mít atom libovolnou energii a jednotlivé energetické stavy tvoří nespojitou řadu, z čehož vyplývá, že atom musí přijímat energii po kvantech. Vyšší energetické stavy jsou nestabilní a atom|atomy se po určité době vracejí do svého stabilního ustáleného stavu. Časový interval návratu do základního stavu bývá většinou velmi krátký. Přebytečná energie je vyzářena v podobě kvanta zářivé energie - fotonu.
Principy fluorescence[upravit | editovat zdroj]
Fluorescence je sekundární záření, které je charakterizováno vyzářením energie ve velmi krátké době, řádově 10-9 s až 10-6 s. Emitované záření je vyzářeno atomem, který energii pohltil. Jedná se o přechod z prvního singletového stavu (S₁) do singletové hladiny (S₀). Fluorescence nese svůj název podle minerálu fluoritu neboli kazivce (CaF₂), u kterého byl tento jev poprvé pozorován. U anorganických sloučenin je fluorescence pozorována zřídka (například u soli vzácných zemin, sloučenin uranylu apod.). Častěji je tedy možné fluorescenci pozorovat u organických látek, z nichž nejčastěji využívanými jsou sloučeniny obsahující aromatické cykly.
Charakteristiky fluorescence[upravit | editovat zdroj]
Hlavní charakteristiky fluorescence jsou následující:
- intenzita – počet fotonů procházejících v daném směru jednotkovou plochou za jednotku času
- spektrální složení – spektrální hustota fotonového toku na jednotkový interval vlnových délek nebo frekvencí
- polarizace – směr kmitání elektrického vektoru elektromagnetické vlny
- doba dohasínání – je dána vnitřní dobou života excitovaného stavu, z něhož dochází k emisi; úzce souvisí s pochody vedoucími k nezářivé deaktivaci tohoto stavu
- koherenční vlastnosti – vztahy mezi fázemi světelných vln
Intenzita fluorescence[upravit | editovat zdroj]
Intenzita fluorescence je úměrná intenzitě absorpce násobené kvantovým výtěžkem fluorescence. Jestliže fluorescenci měříme pod „magickými“ úhly 54°44´8´´ nebo 125°15´51´´ ke směru excitačního paprsku, potom není její intenzita ovlivněna případnou anizotropií emise systému. Při použití citlivých fotonásobičů pro detekci fluorescenčního záření a při buzení intenzivním světlem lze detekovat koncentrace rozpuštěných látek až 10-12 mol/l, což je alespoň o 4 řády vyšší citlivost, než pro absorpční měření. Protože kvantový výtěžek fluorescence roztoků složitých molekul je obvykle nezávislý na vlnové délce budícího záření, je excitační spektrum fluorescence zředěných roztoků přesnou replikou jejich absorpčního spektra a lze tak spektrofluorimetricky získat absorpční spektrum fluoreskující látky při daleko nižších koncentracích, než při přímém měření absorpce na spektrofotometru.
Závislost intenzity fluorescence na vlnové délce[upravit | editovat zdroj]
- Emisní spektrum je závislost intenzity fluorescence na vlnové délce (nebo energii, vlnočtu, či frekvenci) při konstantní vlnové délce budícího záření.
- Excitační spektrum je závislost intenzity fluorescence na vlnové délce (nebo energii, vlnočtu, či frekvenci) při konstantní vlnové délce emitovaného záření.
Každá látka je charakterizována dvěma typy spekter - excitačním a emisním spektrem. Excitační spektrum zachycuje relativní účinnost různých vlnových délek excitujícícho záření. Jedná se tedy o závislost intenzity fluorescence na vlnové délce excitujícího záření měřené při konstantní vlnové délce fluorescence. Emisní spektrum je pak závislostní intenzity fluorescence na vlnové délce při konstantní vlnové délce excitačního záření. Je-li molekulou vyzářena veškerá absorbovaná energie, má fluorescence stejnou vlnovou délku jako absorbované záření (tzv. rezonanční fluorescence). Tento jev je možné sledovat převážně u nejjednodušších dvouatomových molekul v plynné fázi. U složitějších molekul, zvláště v kapalných roztocích, dochází také k nezářivým deaktivacím, jež jsou spojeny s vnitřní či vnější konverzí. Vnitřní konverze je spojena s přechodem molekuly do stavu, který odpovídá jiné kombinaci energetických hladin. Tento přechod je nejčastěji spojen se změnou vibrace molekuly a je často pozorován u alifatických molekul. U látek s rigidní cyklickou strukturou je tento typ konverze málo častý. Nejběžnějším typem vnitřní konverze je vibrační deaktivace, kdy molekula přechází do nejnižší vibrační hladiny daného elektronového stavu. Vnější konverze je vyvolána převážně srážkami excitovaných molekul s molekulami rozpouštědla, kterým je předávána energie. Vnější konverzi je možno omezit ve prospěch zářivé deexcitace silným ochlazením roztoku. V případě nezářivé deexcitace má emitované záření větší vlnovou délku, než je vlnová délka excitačního záření. Tohoto principu je využíváno fluorescenční mikroskopii.
Základní spektrální charakteristiky[upravit | editovat zdroj]
- Kashovo pravidlo:
Před emisí fluorescenčního kvanta dochází obvykle k relaxaci vibrační energie a vnitřní konverzi, takže fluorescenční přechod nastává z nejnižší vibrační hladiny prvního excitovaného stavu S1.
- Vavilovův zákon:
Kvantový výtěžek a doba trvání excitovaného stavu složitých molekul v roztoku nezávisí na vlnové délce budícího záření. Z toho vyplývá obecná vlastnost fluorescence: Emisní spektra jsou nezávislá na vlnové délce excitace.
Polarizace fluorescence[upravit | editovat zdroj]
Je-li roztok fluoroforů excitován lineárně polarizovaným zářením, potom budou excitovány pouze ty molekuly, které mají nenulový průměr svého absorpčního přechodového momentu do směru polarizace (fotoselekce). Je-li průměrná rotační relaxační doba (charakterizující rotační difúzi v roztocích) mnohem delší než doba dohasínání fluorescence, potom také výsledná fluorescence bude polarizována. Bude-li naopak průměrná rotační relaxační doba mnohem kratší než doba dohasínání fluorescence, potom anizotropie systému klesne ještě před emisí na limitní hodnotu (v izotropním systému o malé viskozitě až na nulu). Pokud jsou doba dohasínání fluorescence a rychlost molekulární reorientace srovnatelné, potom bude polarizace fluorescence modulována molekulárním pohybem a analýza časové závislosti emisní anizotropie bude poskytovat informaci o anizotropii systému, v němž se fluorofor nachází.
Měření polarizace fluorescence poskytuje informace o molekulární orientaci a pohyblivosti a procesech, které je modulují, např.:
- fluidita membrán
- interakce ligand-receptor
- proteolýza
- interakce protein-DNA
- kontrakce svalů
- aktivita proteinkináz
Zhášení fluorescence[upravit | editovat zdroj]
Zhášení fluorescence lze definovat jako bimolekulární proces, který snižuje kvantový výtěžek fluorescence beze změny fluorescenčního emisního spektra. Může být důsledkem různých procesů. Srážkové (dynamické) zhášení nastává, když je fluorofor v excitovaném stavu deaktivován (tj. navrací se nezářivě do základního stavu) při srážce s molekulou zhášedla. Molekuly nejsou při tomto procesu chemicky změněny na rozdíl od statického zhášení, kdy se po kontaktu fluoroforu a zhášedla vytváří nefluorescenční komplex. Samozhášení je zhášení fluoroforu jím samotným; nastává při jeho vysokých koncentracích nebo při vysoké denzitě značení.
Fluorescenční barviva[upravit | editovat zdroj]
Fluorescenční barviva (fluorofory, fluorochromy) jsou chemické sloučeniny, které obsahují ve své molekule reaktivní skupinu, která je schopna reagovat s nukleofilními skupinami (NH₂, OH, SH). Obecně se fluorofory dělí na vnitřní (vlastní, intrinsic) a vnější (nevlastní, extrinsic).
Vnitřní fluorescence[upravit | editovat zdroj]
Vnitřní fluorescence buněk je dána přítomností vnitřních fluoroforů, mezi které patří proteiny, redukované formy NADH a NADPH, vitamin A, cytochromy, peroxidáza, hemoglobin, myoglobin či chlorofyl. Proteiny vyzařují fluorescenční záření v UV oblasti spektra. Hlavními fluorofory v proteinech jsou aromatické aminokyseliny (fenylalanin, tryptofan, tyrosin), jejichž absorpční i emisní pás leží mezí 240 a 300nm. Ostatní uvedené látky vyzařují ve viditelné oblasti spektra (modrá, žlutá či červená).
Vnější fluorescence[upravit | editovat zdroj]
Vnější fluorofory jsou používány mnohem častěji než vnitřní. Jsou přidávány ke studovanému vzorku a podle typu vazby jsou děleny na fluorescenční značky a fluorescenční sondy. Vnější fluorofory se dále dělí do dvou skupin podle kvantového výtěžku fluorescence. Fluorescenční barviva používaná v klasické fluorescenční cytochemii (například flourescencin, akridinová oranž, atd.) jsou látky jejichž kvantový výtěžek fluorescence se nemění po přidání ke studovanému vzorku. Do druhé skupiny patří látky (např. 1,6-difenyl-1,3,5-hexatrien), kde kvantový výtěžek závisí na bezprostředním okolí fluoroforu.
Fluorescenční značky[upravit | editovat zdroj]
Fluorescenční značky se nejčastěji používají k fluorescenčnímu značení proteinů, ke kterým se vážou kovalentní vazbou. V některých aplikacích je také využívána vazba biotin-avidin, kdy je studovaná molekula (receptor, polynukleotid, polysacharid atd.) označena biotinem a poté je detekována fluorescenčně značeným avidinem. Nejznámějšími fluorescenčními značkami jsou FITC (fluorescein-5-isothiokyanát) a TRITC (tetramethylrhodamin-5-isothiokyanát, tetramethylrhodamin-5-isothiokyanát). FITC je barvivo a absorpčním maximem při 495 nm, maximální fluorescencí při vlnové délce 519 nm (zelený fluorofor) a molekulovou hmotností 389. Nevýhodou je, že jeho citlivost je značně ovlivněna hodnotou pH. Další nevýhodou všech derivátů fluoresceinu je jejich poměrně snadná fotodestrukce. Proto byly připraveny difluoroderiváty,které jsou stabilnější vůči světelnému záření a navíc mají nižší disociační konstantu pKₐ, což přispívá ke snížení závislosti citlivosti fluorescence na pH. Nová skupina fluorescenčních značek je označována BODIPY. Tyto fluorofory obsahují atomy bóru. Mají vysoký kvantový výtěžek fluorescence, poměrně široké emisní spektrum a nejsou závislé na polaritě prostředí a pH.
Fluorescenční sondy[upravit | editovat zdroj]
Fluorescenční sondy jsou vnější fluorofory, které se váží ke struktuře nekovalentní vazbou a často při tom mění své fluorescenční vlastnosti. Tyto fluorofory jsou používány ke studiu změn konformace bílkovin, tloušťky membrán, membránového potenciálu apod. Pro FISH jsou nejdůležitější sondy pro nukleové kyseliny. Je známo, že nukleové kyseliny nefluoreskují, nebo jen slabě. K identifikaci a vizualizaci chromozomů se používá tato fluorescenční řada fluorescenčních sond (např: akridinová oranž, ethidium bromid, DAPI a další). Nejznámější a také nejpoužívanější fluorescenční sondou pro vizualizaci veškeré jaderné DNA je posledně zmiňovaná DAPI. Chemicky se jedná o 4',6-Diamidino-2-fenylindol. Jeho absorpční maximum je při 345 nm, maximální fluorescence je při 455 nm (modrý fluorofor) a má molekulovou hmotnost 277. Dalším často používaným fluoroforem je akridinová oranž. Jedná se o fluorescenční sondu, jejíž absorpční a emisní pásma se liší podle substrátu, ke kterému je vázána DNA/RNA. Obě jmenované jsou většinou dodávány v podobě chloridových solí.
Využití fluorescence[upravit | editovat zdroj]
Fluorescence je v medicíně nejčastěji využívána jako principiální prvek některých laboratorních analytických metod.
Přístroje, které jsou založené na měření fluorescence, se rozdělují do čtyř typů:
- spektrofluorimetry – měří střední signál celého vzorku umístěného obvykle v kyvetě nebo v jamce mikrodestičky
- fluorescenční mikroskopy – umožňují pozorovat fluorescenci dvojrozměrných nebo trojrozměrných mikroskopických objektů. Využití fluorescence v mikroskopii se stalo základem právě fluorescenční mikroskopie, která nachází široké uplatnění zejména v medicíně a v oblasti přírodních věd. Pokud kupříkladu na jednu protilátku navážeme fluorescein (emituje zelené světlo při excitaci modrým světlem) a na jinou rhodamin (emituje červené světlo při excitaci žluto-zeleným světlem), pak můžeme porovnávat vzájemné pozice různých molekul ve stejné buňce apod.
- fluorescenční skenery (včetně čteček mikrodestiček) – měří fluorescenci dvojrozměrných makroskopických objektů (elektroforetické gely, bloty, chromatogramy)
- průtokové cytometry – měří fluorescenci velkého množství jednotlivých buněk a umožňují identifikaci a separaci jejich subpopulací
Odkazy[upravit | editovat zdroj]
Související články[upravit | editovat zdroj]
Použitá literatura[upravit | editovat zdroj]
- KOČÁREK, Eduard a Martin PÁNEK. Klinická cytogenetika I : úvod do klinické cytogenetiky. 2. vydání. Praha : Karolinum, 2010. 134 s. ISBN 978-80-246-1880-7.
Internetové zdroje[upravit | editovat zdroj]
- FIŠAR, Zdeněk. FLUORESCENČNÍ SPEKTROSKOPIE V NEUROVĚDÁCH : Principy fluorescenční spektroskopie [online]. [cit. 2012-01-26]. <http://psych.lf1.cuni.cz/fluorescence/Default.htm>.
- ., .. Mikroskopy : Fluorescence [online]. [cit. 2012-01-26]. <https://www.mikroskop-mikroskopy.cz/fluorescence/>.