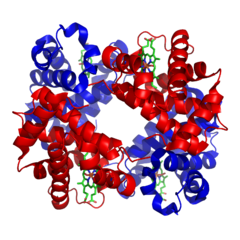
Hemoglobin
Hemoglobin (Hb) je tetramerní metaloprotein, který je součástí erytrocytů obratlovců a některých dalších živočichů. Zásadní funkcí tohoto proteinu je přenos krevních plynů (zejména kyslíku). V erytrocytech savců tvoří cca 35 % celkového obsahu. Na jednu červenou krvinku připadá průměrně 28–32 pikogramů.[1] Uplatňuje se jako nárazníkový systém krve.
Referenční hodnoty pro množství hemoglobinu v krvi jsou proměnlivé dle jednotlivých pracovišť.[2] [3]. Zde uvádíme přibližné fyziologické hodnoty dle učebnice prof. Trojana. [1]
| Jedinec | Množství |
|---|---|
| Muži | 135–170 g/l |
| Ženy | 120–160 g/l |
| Novorozenec | 120–180 g/l |
Stavba[upravit | editovat zdroj]
Molekula hemoglobinu je sférického tvaru a skládá se ze 4 podjednotek. Každá podjednotka je tvořena bílkovinnou částí – globinem a prostetickou (nebílkovinnou) částí – hemem. Všechny lidské hemoglobiny mají stejný hem, liší se v globinové složce.
Hem[upravit | editovat zdroj]
Hem je komplexní sloučenina tvořená tetrapyrolovým kruhem (protoporfyrin IX) s centrálním atomem železa — Fe 2+. Přítomnost kovů je pro tetrapyroly typická (př. hořečnatý ion v chlorofylu).
Globin[upravit | editovat zdroj]
Globin je tvořen čtyřmi polypeptidy. Zaujímá asi 96 %[1]celé molekuly. Vždy dvojice polypeptidových řetězců je stejná. V lidském organismu se vyskytují řetězce alfa, beta, gama, delta atd. Na základě přítomnosti jednotlivých řetězců v molekule pak hovoříme o různých typech hemoglobinu. Vzájemně se liší afinitou k molekule kyslíku (schopnost vázání nebo uvolňování samotné molekuly O2).
Typy hemoglobinu[upravit | editovat zdroj]
Rozlišujeme několik typů hemoglobinu měnící se v průběhu vývoje jedince.
| ontogeneze | typ Hb | zastoupení polypeptidových řetězců |
|---|---|---|
| Zárodek | Portland 1 | ζ2γ2 |
| Portland 2 | ζ2β2 | |
| Gower 1 | ζ2ε2 | |
| Gower 2 | α2ε2 | |
| Plod | HbF | α2γ2 |
| Dítě | ↓HbF | α2γ2 |
| ↑HbA | α2β2 | |
| Dospělý | HbA | α2β2 |
| HbA2 | α2δ2 | |
| Srpkovitá anémie | HbS |
Lokalizace genů pro globinové řetězce[upravit | editovat zdroj]
- Skupina (cluster) genů příbuzných α-genu je lokalizována na 16 chromosomu (16p13). Lokus pro α-globin je tetraplikován a gen pro zeta globin duplikován.
- Skupina (cluster) genů příbuzných β –genu je lokalizována na 11 chromosomu (11p15.5) a je tvořena genem beta a delta, genem gama G a gama A a genem epsilon.
Mechanismus přepínání transkripce genů globinu je následující: Transkripce genů hemoglobinu je aktivována v erytrocytech vazbou bílkoviny NF-E1 se specifickým DNA vážícím faktorem. DNA tak vytváří kličky, jelikož velikost rozhoduje o aktivaci lokusů pro tvorbu embryonálního, fetálního a dospělého hemoglobinu. DNA vážící faktory jsou tkáňově specifické a lokalizace krvetvorby tak ovlivňuje typ syntézy hemoglobinu.
Změny struktury hemoglobinu v ontogenezi[upravit | editovat zdroj]
Jedná se o typický příklad regulace genové exprese v ontogenezi. V půběhu vývoje dochází ke změnám v expresi jednotlivých genů – tzv. přepínání (switching) globinů. Nejprve je zahájena syntéza zeta a epsilon globinů (HbGower 1). Následně dochází k expresi alfa a gama a globinů a vzniká tak fetální HbF; současně jsou suprimovány zeta a epsilon geny a ve fetálním období se tvoří převážně HbF. U novorozence obsahují erytrocyty si 70 % HbF; v dospělosti již jen 1 %.
Regulace tvorby hemoglobinu v ontogenezi souvisí s lokalizací tvorby červených krvinek. Embryonální hemoglobin se tvoří ve žloutkovém váčku, fetální v játrech a dospělý v kostní dřeni.
Deriváty hemoglobinu[upravit | editovat zdroj]
Deriváty hemoglobinu vznikají zpravidla navazováním plynných látek na molekulu Hb, což různými způsoby ovlivňuje její vlastnosti. Výhodná pro organismus je zejména schopnost vázat dýchací plyny (kyslík, oxid uhličitý). Navázání některých jiných látek (např. oxidu uhelnatého) může mít naopak vážné patologické důsledky.
Saturační křivka hemoglobinu[upravit | editovat zdroj]
Schopnost hemoglobinu vázat a uvolňovat molekuly plynů (zejména kyslíku) je znázorňována saturační křivkou. Změny pH, teploty, parciálních tlaků plynů a dalších proměnných pak způsobují změny afinity molekuly Hb, což se projeví posunem křivky.
Odkazy[upravit | editovat zdroj]
Související články[upravit | editovat zdroj]
- Hemoglobin jako pufr
- Hemoglobin v moči
- Hemoglobin a jeho deriváty (LF MU)
- Hemoglobin a jeho deriváty (1. LF UK, VL, Praktická cvičení z biochemie)
Literatura[upravit | editovat zdroj]
- KITTNAR, O, et al. Lékařská fyziologie. 1. vydání. Grada, 2011. ISBN 978-80-247-3068-4.
- TROJAN, S, et al. Lékařská fyziologie. 3. vydání. Grada, 1999. ISBN 80-7169-788-5.
- ŠTEFÁNEK, Jiří. Medicína, nemoci, studium na 1. LF UK [online]. [cit. 11. 2. 2010]. <http://www.stefajir.cz>.
Reference[upravit | editovat zdroj]
- ↑ a b c TROJAN, Stanislav a ET AL.. Lékařská fyziologie. 4. vydání. Praha : Grada, 2003. 772 s. s. 128. ISBN 80-247-0512-5.
- ↑ Mayo clinic. Hemoglobin test results [online]. [cit. 2016-07-20]. <https://www.mayoclinic.org/tests-procedures/hemoglobin-test/about/pac-20385075>.
- ↑ ÚLBLD LF1. Referenční meze pro hemoglobin [online]. [cit. 2016-07-20]. <https://ulbld.lf1.cuni.cz/seznam-lab-vysetreni?vysetreni=1463>.