Protilátka
(přesměrováno z Imunoglobuliny)
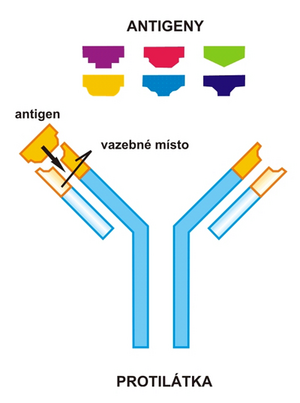
Protilátka je látka bílkovinné povahy, patřící do imunoglobulinové rodiny. Specificky se váže na antigen. Vzniklá vazba má charakter nekovalentních interakcí. V průběhu specifické imunitní odpovědi humorálního typu jsou tyto látky tvořeny B-lymfocyty a plasmatickými buňkami, jež z B-lymfocytů v rámci terminální diferenciace vznikají. Imunoglobuliny najdeme u obratlovců v krevním séru, tělních tekutinách a také na povrchu B-lymfocytů. Protilátky mají krátké biologické poločasy – od 2 do 23 dní. Hrají zásadní roli v obraně organismu.
Funkce
Protilátky slouží při obraně proti:
- extracelulárním bakteriím,
- intracelulárním bakteriím (mnohem menší měrou),
- parazitům,
- toxinům – neutralizací toxinu, zabráněním adheze mikroorganismu.
Aktivují některé složky imunitního systému:
- aktivují cytotoxické reakce – aktivací komplementové kaskády nebo NK-buněk,
- zahájení zánětlivé odpovědi – degranulací žírných buněk či bazofilů,
- opsonizace – usnadňující fagocytózu.
In vitro se protilátky pro specifitu vazby s antigenem používají k průkazu různých molekul (imunochemie, imunohistochemie, ELISA apod.).
Struktura
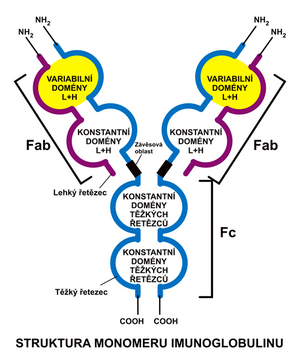
Každá protilátka je složena ze dvou totožných těžkých (označovaných H dle angl. heavy) a dvou totožných lehkých řetězců (L dle angl. light). Lehké a těžké řetězce se liší počtem aminokyselin i molekulovou hmotností. Řetězce jsou vzájemně svázány kovalentními disulfidickými můstky. Celá makromolekula má tvar písmena ypsilon s výkyvnými raménky. Mezi lehkým a těžkým řetězcem nacházíme vždy jeden disulfid; mezi dvěma těžkými řetězci jich bývá různý počet – dle třídy a podtřídy protilátky. Imunoglobulinové řetězce je možno dle jistých podobností ve struktuře rozdělit na několik homologních domén.
Lehké řetězce
Sestávají se z variabilní a konstantní domény – ty bývají označovány jako VL a CL. Vyskytují se ve dvou typech: κ a λ. Ty vykazují jisté odlišnosti v konstantním úseku. V jedné imunoglobulinové molekule jsou vždy oba řetězce téhož typu. U člověka je častější typ κ.
Těžké řetězce
Mají vždy jednu doménu variabilní a tři (IgA, IgD, IgG), případně čtyři (IgE, IgM) konstantní. Obdobně jako u lehkých řetězců jsou zde označovány VH a CH1-4. Pro dělení protilátek na třídy (IgA, IgD, IgE, IgG, IgM) je směrodatný druh těžkého řetězce, který je v molekulách přítomen. Těchto druhů je pět – bývají analogicky označovány řeckými písmeny (α, δ, ε, γ, μ). Liší se jak složením, tak svou velikostí. Konstantní oblast, tvořená konstantními doménami (Fc fragment) v těžkých řetězcích převažujících, je totožná ve všech protilátkách téže třídy. Variabilní oblast se liší dle klonu B-lymfocytů, jímž je produkována. Na těžký řetězec se váží cukerné složky molekuly.
Vazebné místo
Variabilní domény lehkého i těžkého řetězce vytvářejí vazebné místo. Oba řetězce ve skutečnosti nezaujímají konformaci, jež je znázorněna na obrázku, ale jsou stočeny do kompaktních globulí, tzv. imunoglobulinových domén. Příčinou této vnitřní rotace jsou disulfidické můstky. Domény, ležící proti sobě, mají vždy homologní sekvenci aminokyselin.
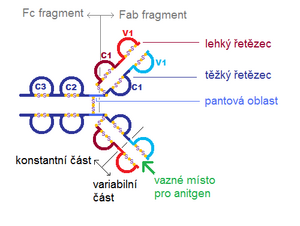
Pantová oblast
Rostlinným enzymem papainem lze imunoglobulinové molekuly rozštěpit. To probíhá na těžkém řetězci v tzv. pantové oblasti. Protilátku tak lze rozdělit na tři části:
- dvě části obsahující obě rozvětvená ramena (tedy celý lehký a část těžkého řetězce), tzv. Fab-fragment,
- druhá část obsahuje zbývající části obou řetězců těžkých, spojené disulfidickými můstky, tzv. Fc-fragment.
Na Fab-fragmenty se mohou vázat antigeny, Fc-fragmenty se váží na receptory na povrchu leukocytů. Obdobně se protilátky štěpí i pepsinem, pak ale vzniká jeden Fc fragment a jeden bivalentní Fab fragment.
Vlastnosti
Hypervariabilní úseky
Antigen se specificky váže na variabilní úseky těžkých a lehkých řetězců. Ty umožňují bezprostřední kontakt. Jsou to vlastně vychlípeniny řetězců na jejich N-koncích. Právě ony jsou příčinou prostorové komplementarity, připomínající specifickou vazbu mezi enzymem a substrátem.
Počet vazebných míst
Liší se podle třídy imunoglobulinu:
- IgG má dvě (bivalentní),
- sekreční IgA čtyři,
- IgM teoreticky deset, praktická vaznost je však jen asi poloviční.
Komplex antigen-protilátka není svázán kovalentně, nýbrž pouze nechemickými interakcemi. Tvorba neodpovídá stechiometrickým poměrům. Vzniká-li precipitát, odpovídá jeho maximální množství zóně ekvivalence – při nadbytku kterékoli ze složek se však již množství sraženiny snižuje, neboť nedochází k uspořádání optimální prostorové sítě (viz obrázek). Nicméně při některých jiných druzích interakce imunokomplexy mohou být i rozpustné.
Velikost komplexu antigen-protilátka
Je velmi různá. Některé jsou tak rozměrné, že je můžeme pozorovat elektronovým mikroskopem. Malé komplexy mají krátký poločas, nevážou komplement a nejsou patogenní. Komplexy střední velikosti se ukládají do tkání a pro různé choroby tak mohou být charakteristickým rysem.
Interakce antigenu s protilátkou
Může také vyvolávat:
- shlukování,
- lýzu,
- imobilizaci buněk (červených krvinek),
- fixaci komplementu.
V některých případech může dojít navázáním příslušného imunoglobulinu k částečné nebo dokonce úplné neutralizaci bakteriálního toxinu.
Vytváření protilátek a jejich další funkce
Lidské tělo je schopno vyrobit více než milion různých protilátek. Tuto obrovskou rozmanitost nezpůsobují jen geny (těch jsou pouze stovky) – každý L-řetězec je však produktem minimálně tří samostatných genů, H-řetězec čtyř.
Protilátky jsou při obraně organismu aktivní v několika směrech. Imunoglobuliny navázané na povrchové antigeny, kupř. u mikroorganismu, přitahují iniciální fragmenty komplementové kaskády (C1) a tak ji klasickou cestou aktivují. To způsobuje úhyn bakterie hned dvěma mechanismy:
- opsonizací – navázání protilátky a určitých složek komplementu – označuje mikroorganismus a atraktivizuje jej pro fagocyty,
- komplementovým systémem – vytváří komplex, vytvářející póry v cytoplasmatické membráně a tím způsobující únik organel mikroba.
Imunoglobuliny tvoří také jednu ze součástí lymfocytárních receptorů, BCR i TCR:
- BCR
Je složen z vlastního povrchového imunoglobulinu, přičemž těžké řetězce Ig (nejčastěji IgM či IgD) procházejí membránou a asociovaných signalizačních molekul – rovněž procházejí membránou, ty jsou označovány jako Igα a Igβ. Jsou spojeny s cytoplazmatickými tyrosinkinázami Janusova typu (JAK). Při navázání antigenu na alespoň dvě molekuly BCR dojde k přiblížení asociovaných proteinů, aktivaci tyrosinkinas a spuštění signalizační kaskády.
- Komplex TCR
Složen z imunoglobulinům podobného modulu rozeznávajícího antigen – je složeném z transmembránových α a β či γ a δ řetězců a asociovaný s CD3 komplexu asociovaných proteinů. T-lymfocyty s TCR receptory typu α-β dokáží antigen rozeznat pouze je-li navázán na povrchu antigen prezentující buňky, v komplexu s proteiny MHC II. třídy.
Třídy
Podle stavby konstantní části těžkého řetězce dělíme protilátky na třídy. Výrazný rozdíl mezi jednotlivými Ig třídami je v zastoupení sacharidů:
- v IgG – 2–3 %,
- v IgA – 5–8 %,
- v IgM – 12 %,
- v IgD – 9–14 %,
- v IgE – 12 %.
IgG
IgG je nejvýznamnější třída protilátek. Tvoří ¾ všech protilátek v séru, jeho koncentrace je 10 g/l. Vytváří 4 podtřídy (IgG1–4), které se vzájemně liší svými opsonizačními vlastnostmi, vazbou na komplement a časem, po který jsou aktivní. Je to také jediná třída protilátek schopná procházet placentou. Proto jsou u novorozenců stejné hodnoty jako u dospělých. Nejnižší hladina u zdravého jedince je mezi 3. a 6. měsícem postnatálního života (přechodná hypogamaglobulinemie). To vede k náchylnosti novorozenců k infekčním onemocněním.
- Stavba
Molekula IgG je složená ze dvou lehkých a dvou těžkých řetězců. Lehké řetězce se skládají z 1 variabilní a 1 konstantní imunoglobulinové domény. Těžké řetězce jsou složeny z 1 variabilní a 3 konstantních domén. Protilátky třídy IgG se vyskytují v monomerní podobě.
- Význam
- opsonizace – na neutrofilech a makrofázích se vyskytují receptory FcR pro Fc-fragmenty IgG,
- aktivace komplementu klasickou cestou – po vazbě IgG na antigen,
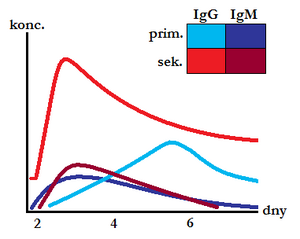
- sekundární imunitní reakce – opakované setkání s antigenem,
- neutralizace toxinů – po navázání IgG dojde k zablokování a neutralizaci toxinu vytvořením imunokomplexu.
IgA
Protilátky třídy IgA jsou také nazývány slizniční protilátky. Jsou totiž produkovány B-lymfocyty, které vyskytují ve slizničních vrstvách. V séru je jejich koncentrace 1,5 g/l, ovšem celkově v těle jsou to nejzastoupenější protilátky. Jejich poločas je asi 1 týden.[1]
- Struktura
Protilátky třídy IgA jsou strukturně podobné IgG. Jejich molekula je tvořena 2 lehkými a 2 těžkými řetězci. Lehké řetězce jsou tvořeny 1 variabilní a 1 konstantní imunoglobulinovou doménou. Těžký řetězec je tvořen 1 variabilní a 3 konstantními doménami. Na rozdíl od IgG se mohou vyskytovat jako monomery, častěji jako dimery, spojené J-řetězcem. Dimerní podoba IgA se vyskytuje v séru, pokud je IgA sekretováno na povrch sliznic je ještě spojeno tzv. sekreční komponentou. Jedná se o protein, připojený k normálnímu dimeru IgA a chrání protilátku proti štěpícím enzymům.[1]
- Funkce
- blokáda adhezních molekul – reagují s adhezními molekulami bakterií,
- opsonizace – váže se na specifické Fc-α-receptory fagocytů.
IgA nemá schopnost aktivovat komplement.[1]
IgM
Protilátky třídy IgM tvoří 10 % všech protilátek v séru, přičemž jejich koncentrace je 1–1,5 g/l. Monomer IgM je integrální součástí membrány B-lymfocytů (BCR). IgM mají krátký poločas, na rozdíl od IgG přetrvávají v plasmě jen krátce po zlikvidování antigenu.
- Struktura
Celek protilátek IgM tvoří pentamer, jednotlivé podjednotky jsou spojeny do kruhu cystinovými můstky a jedním J řetězcem. Díky této struktuře nepronikají do tkání, zůstávají v cévním řečišti. Teoreticky se tímto uspořádáním vytvoří 10 vazebných míst pro antigen, prakticky je použitelných pět, ostatní jsou prostorově blokována. Podjednotky mají obdobnou strukturu jako IgE protilátky, jejich těžký řetězec je tvořen 1 variabilní a 4 konstantními imunoglobulinovými doménami.
- Funkce
- aktivuje komplement – po navázání IgM na antigen se na imunokomplex váže komplement, který se aktivuje klasickou cestou,
- jako jediný tvoří odpověď na polysacharidové antigeny (AB0 systém),
- aglutinace – IgM je schopné navázat hodně antigenů a proto snadno tvoří aglutináty.
Při zahájení specifické imunitní reakce jsou vytvářeny jako první, jejich produkce nevyžaduje izotypový přesmyk. Pokud dochází k infekci fétu, jsou IgM přítomny již při narození. Existuje malé množství tvorby sekrečního IgM.
IgM nemá opsonizační funkci.
- Diagnostický význam
- pro sekundární imunitní reakce – pozitivní průkaz IgM proti antigenu poukazuje na akutní infekci
Je zvláště účinný proti bakteriím a virům
IgD
Monomerní protilátka. V séru je zastoupen relativně málo. Má poměrně malou afinitu k antigenům. Nachází se hlavně na povrchu B-lymfocytů, kde má funkci receptoru pro antigen – tvoří BcR (B-celulární receptor). Vyvolává uvolňování histaminu z mastocytů a bazofilních leukocytů. Po vazbě na antigen se také spolupodílí na rozvoji senné rýmy či alergického astmatu.
IgE
Ze všech protilátek má nejkratší poločas rozpadu. Nalezneme jej v množství ještě nižším než IgD (sérová koncentrace 0,5 g/l) – to způsobuje také jeho krátký katabolický poločas. Je homocytotropní – brzy se váže na jiné buňky vlastního těla (žírné buňky, bazofily) na receptory FcεRI. Ve vázaném stavu je daleko stabilnější než jako volný. Uvolňuje mediátory zánětu (histamin, serotonin, prostaglandiny, leukotrieny).
Protilátky IgE jsou zodpovědné za reakce časné přecitlivělosti. Jejich zvýšená koncentrace bývá při alergických (atopických) reakcích. Dále mají úlohu v antiparazitární obraně (stimuluje procesy k vypuzení): mediátory, vazodilatace, vykašlání, vykýchání, zvýšení peristaltiky střev, průjem. Vyskytují se zvláště ve slezině, mandlích, mukózních membránách plic a mukózních membránách gastrointestinálního ústrojí.
Odkazy
Související články
- Slizniční imunitní systém
- Autoprotilátky
- Terapeutické využití imunoglobulinů
- IgG
- IgM
- IgA
- IgE a IgD
- Plasmatické bílkoviny
- Antigen
Reference
- ↑ a b c HOŘEJŠÍ, Václav a Jiřina BARTŮŇKOVÁ. Základy imunologie. 3. vydání. Praha : Triton, 2008. 280 s. ISBN 80-7254-686-4.
Použitá literatura
- HOŘEJŠÍ, Václav a Jiřina BARTŮŇKOVÁ. Základy imunologie. 3. vydání. Praha : Triton, 2005. ISBN 80-7254-686-4.
- LEDVINA, Miroslav, et al. Biochemie pro studující medicíny. II. díl. 1. vydání. Praha : Karolinum, 2005. ISBN 80-246-0850-2.
- MURRAY, Robert K, et al. Harperova biochemie. 4. vydání. Praha : H & H, 2002. ISBN 80-7319-013-3.
- ŠTERZL, Ivan, et al. Základy imunologie. 1. vydání. Praha : Karolinum, 2005. ISBN 80-246-0972-X.