Konduktometrie
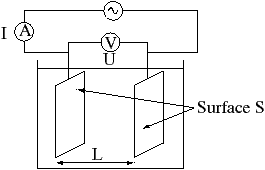
Konduktometrie je jedna z nejstarších elektroanalytických metod, která se zabývá měřením vodivosti roztoků elektrolytů ve vodě nebo i v jiném rozpouštědle o velké relativní permitivitě, kde dochází k disociaci elektrolytu na ionty. Konduktometrie je založena na schopnosti roztoku elektrolytu vést elektrický proud a konduktometrický článek je tvořen dvěma kovovými, nejčastěji platinovými elektrodami ponořenými v analyzovaném roztoku. Přitom při nízkofrekvenční konduktometrii se pro měření používá střídavý proud, čímž nedojde k polarizaci platinových elektrod.
Hodnota vodivosti elektrolytu závisí na
- migraci iontů přítomných v roztoku k elektrodám tj. na pohyblivosti
- počtu iontů a jejich náboji
a je charakterizována měrnou vodivostí X (jednotka: mS.m−1).
X = 1/R. l/S
Protože vodivost G = 1/R (jednotka vodivosti siemens S) a odporová konstanta vodivostní nádobky KR = l/S (l = vzdálenost, S = plocha elektrod), čili
X = G. KR
Vodivostní nádobka je přitom realizována dvěma nepolarizovatelnými platinovými elektrodami − plíšky o ploše 1 cm2 vestavěné do skla na vzdálenost 1 cm v tomto případě je hodnota KR jednotková a změřená hodnota proto přímo odpovídá měrné vodivosti.
Vodivost roztoků je možné měřit metodou[upravit | editovat zdroj]
1. kompenzační, jejichž podstatou je použití Wheatstoneova můstku. Tento způsob měření za použití nulového indikátoru umožňuje přesné změření odporu, není však vhodný pro titrace. Přístroje, které měří tímto kompenzačním způsobem se označují jako konduktoskopy.
2. výchylkovou, která umožňuje měřit odpor mezi elektrodami vodivostní nádobky za proudového stavu. Přístroje − konduktometry umožňují rychlé a přímé odečítání hodnot vodivosti. Měřitelný rozsah vodivosti je od 0,1 μS až do 1 S, celý rozsah je rozdělen na volitelné dílčí rozsahy; přesnost asi do 1%.
Přímá konduktometrie[upravit | editovat zdroj]
Přímá konduktometrie umožňuje na základě měření vodivosti roztoku stanovit koncentraci elektrolytu. Její použití v analytické chemii je však omezené, protože vodivost většiny iontů s výjimkou H3O+ a OH− se liší jen málo a vodivost je vlastností nespecifickou, aditivní. Proto tato metoda není vhodná pro stanovení ve složitějších roztocích. Výhodou je však velká citlivost konduktometrie, která umožňuje stanovit i stopové množství elektrolytů ve vodě. Proto se přimá konduktometrie používá zejména při kontrole čistoty vod. Měrná vodivost je jeden z hlavních ukazatelů kvality např. destilované vody.
Podle lékopisu se kalibrace konduktometrického systému provádí roztokem chloridu draselného o koncentraci 0,02 mol.l−1, jehož měrná vodivost je 250,1 mS.m−1.
Nespecifického charakteru vodivosti se na druhé straně s výhodou využívá v konduktometrických detektorech některých instrumentálních metod jako např. ve vysokoúčinné kapalinové chromatografii nebo izotachoforéze.
Konduktometrická titrace[upravit | editovat zdroj]
Při konduktometrických titracích se využívá změna vodivosti roztoku při titraci k identifikaci ekvivalentního bodu. Konduktometrická titrační křivka je přitom závislost měrné vodivosti nebo celkové vodivosti na přidaném objemu odměrného roztoku. Grafickým znázorněním této závislosti jsou dvě přímkové větve, jedna před a druhá po dosažení ekvivalenčního bodu, jejichž průsečík odpovídá spotřebě odměrného roztoku v ekvivalenčním bodě.
Konduktometrická titrace se provádí podobně jako potenciometrická tak, že se odměrný roztok přidává po částech a po každém přídavku a promíchání se zaznamená údaj spotřeby a vodivosti. Přitom stačí proměřit 3−4 body před a po ekvivalenčním bodě, po jejich grafickém znázornění proložit přímky a odečíst ekvivalenční bod. Aby nebylo třeba zavádět korekci na zředění, způsobené přidávaným odměrným roztokem, je nutné titrovat roztokem alespoň desetkráte koncentrovanějším, než je koncentrace stanovované látky v roztoku.
Největší význam má konduktometrická titrace při stanovení kyselin a zásad. Při přímé titraci kyselin má titrační křivka tvar V, který je dán tím, že molární vodivost reagujících iontů H3O+ a OH− je mnohem větší než vodivost jiných iontů a vznikající voda má vodivost zanedbatelně malou. Pro stanovení slabých kyselin a zásad a velmi zředěných roztoků je konduktometrická titrace (identifikace ekvivalenčního bodu) výhodnější než potenciometrická. Jiný způsob je stanovení amonných solí kyselin titrací hydroxidem. Výhodnou tohoto způsobu je, že je v přebytku amoniaku se rozpouštějí i kyseliny ve vodě málo rozpustné a takto je možné mimo kyselin stanovit např.: též imidy, estery a anhydridy kyselin.
Konduktometrické indikace ekvivalenčního bodu je možné využít i při mnohých srážecích titracích. Jako odměrný roztok při stanovování kationtů se využívá hydroxid nebo např.: 2,3-butandiondioxim; při stanovení aniontů např. síran se titruje octanem barnatým, halogenidy octanem stříbrným apod. Podobně je možné konduktometrické indikace využít i při chelatometrickém stanovení zředěných roztoků kationtů chelatonem 3, přičemž se vznikající vodíkové ionty váží octanem. Pro redoxní titrace je konduktometrická indikace nevhodná.
Odkazy[upravit | editovat zdroj]
Použitá literatura[upravit | editovat zdroj]
- KARLÍČEK, Rolf, et al. Analytická chemie pro farmaceuty. 3. vydání. Praha : Karolinum, 2007. ISBN 9788024614533.