Lipoproteiny (klinika)
Dyslipidémie
Dyslipidémie (dyslipoproteinémie; dříve hyperlipoproteinémie – HLP) představují skupinu metabolických onemocnění, která jsou charakterizována především zvýšenými koncentracemi lipidů nebo lipoproteinů v plazmě v důsledku jejich zvýšené syntézy nebo sníženého odbourávání. Často se ale zvýšení některé frakce krevních lipidů kombinuje se snížením koncentrace HDL cholesterolu.
Dyslipidémie představují jeden z nejvýznamnějších rizikových faktorů aterosklerózy. Komplikace aterosklerózy (akutní infarkt myokardu, cévní mozkové příhody, ischemická choroba dolních končetin) zaujímají přední místo v příčinách mortality a morbidity nejen u nás, ale prakticky ve všech vyspělých státech světa.
Klasifikace dyslipidémií
Dyslipidemie (dále DLP) lze rozdělovat podle různých kritérií:
1. Klasifikace podle příčiny
Primární dyslipidémie
Jsou geneticky podmíněné poruchy metabolismu lipoproteinů. Předpokládá se, že většina HLP je primárních (např. familiární hypercholesterolémie, familiární hypertriacylglycerolémie).
Sekundární dyslipidémie
Jsou důsledkem jiného onemocnění, které narušuje lipidový a lipoproteinový metabolismus. Mohou se projevit izolovaným zvýšením cholesterolu nebo triacylglycerolů nebo obou parametrů. Často doprovází např. diabetes mellitus, hypotyreózu, choroby jater, obezitu, chronický alkoholismus. Jejich nebezpečí spočívá v jejich dlouhodobém bezpříznakovém období, k náhlé manifestaci pak dochází jako komplikace aterosklerózy na různých místech nebo jako akutní hemoragická pankreatitida.
2. Terapeutická klasifikace
Klasifikace dyslipidémií podle Evropské společnosti pro aterosklerózu (1992)
Představuje jednoduché a praktické rozdělení DLP na základě stanovení koncentrace cholesterolu a triacylglycerolů v séru na tři skupiny. Je základem pro rozhodování o terapeutickém postupu.
Hypercholesterolémie
Izolované zvýšení celkového cholesterolu, především v LDL frakci. Obvykle se setkáváme s familiární hypercholesterolémií a polygenní hypercholesterolémií.
- Familiární hypercholesterolémie (FH) je autozomálně dominantní onemocnění, jehož příčinou je genetická porucha v tvorbě nebo funkci LDL receptorů. U homozygotů je katabolismus LDL pomocí LDL receptorů prakticky nefunkční, u heterozygotů je kapacita LDL receptorů snížena na polovinu. V důsledku toho se v krvi hromadí aterogenní LDL částice. Heterozygotní forma je častější a vyskytuje se asi 1 případ na 500 osob. Homozygoti jsou těžce postiženi již od dětství, vyskytují se u nich šlachové a kožní xantomy a většina z nich umírá na infarkt myokardu do 20 let. U postižených heterozygotních osob se manifestuje předčasným výskytem kardiovaskulárních onemocnění (ICHS ve věku 30–50 let), dále se u nich objevuje arcus senilis corneae, xanthelasma palpebrarum nebo šlachová xantomatóza. Koncentrace celkového cholesterolu se pohybují kolem 7–10 mmol/l u heterozygotů a kolem 15–30 mmol/l u homozygotů. Změny v lipoproteinovém spektru odpovídají převážně fenotypu IIa, méně často IIb (podle Fredricksona).
- U polygenní hypercholesterolémie se uplatňují vlivy genetické, ale i vlivy prostředí. V průmyslově vyspělých zemích se s ní setkáváme velmi často. Hodnoty celkového cholesterolu nepřesahují obvykle 8 mmol/l, ale již představují zvýšené riziko aterosklerózy. Změny v lipoproteinovém spektru odpovídají převážně fenotypu IIa, méně často IIb.
- Se sekundární hypercholesterolémií se můžeme setkat např. u hypotyreózy, nefrotického syndromu, při stravě bohaté na nasycené tuky.
Kombinovaná hyperlipidémie
Současné zvýšení cholesterolu i triacylglycerolů.
- Familiární kombinovaná hyperlipidémie patří k nejčastějším primárním HLP. Vyskytuje se ve frekvenci 1:50 až 1:100. Má podklad v geneticky podmíněné zvýšené tvorbě apolipoproteinu B100. Je spojena se zvýšeným rizikem vaskulárních onemocnění. Bývají zvýšeny LDL a VLDL, odpovídající fenotypu IIb, ale setkáme se i s fenotypem IIa, IV a V.
- Sekundární formy nalézáme např. u hypotyreózy, při léčbě kortikoidy.
Hypertriacylglycerolémie
Izolované zvýšení triacylglycerolů:
- Geneticky podmíněnou hypertriacylglycerolémií je familiární hypertriacylglycerolémie, která postihuje asi 0,2–0,3 % populace. Projevuje se zmnožením VLDL, pravděpodobně na podkladě jejich zvýšené tvorby. Současně nacházíme sníženou hladinu HDL-cholesterolu. V laboratorním nálezu se setkáváme s mírně zvýšenými triacylglyceroly, obvykle do 6 mmol/l při normální koncentraci cholesterolu. U nemocných je nebezpečí infarktu myokardu.
- Vzácně se můžeme setkat s familiární hyperlipoproteinémií typu I, charakterizovanou hyperchylomikronémií. Nemocní jsou ohroženi pankreatitidou vyvolanou vysokou hladinou triacylglycerolů (často přes 20 mmol/), která zvyšuje její riziko.
- Sekundární forma hypertriacylglycerolémie je často spojena s diabetem mellitem, obezitou, nadměrným příjmem alkoholu nebo stravy s vysokým obsahem sacharidů.
3. Klasifikace podle Fredricksona
- Klasifikace podle Fredricksona je historicky první klasifikací poruch lipoproteinového metabolismu. V současnosti se od ní upouští, protože neobjasňuje vlastní příčinu choroby a je nahrazována modernějším přístupem, využívajícím nové poznatky v etiopatogenezi HLP. Stručně si ji probereme, protože ve starší literatuře se s ní ještě setkáváme. Na základě koncentrace cholesterolu a triacylglycerolů v séru a elektroforetického vyšetření lipoproteinů byly HLP rozděleny do 5 lipoproteinových typů – fenotypů (podle WHO byl typ II později rozdělen na IIa a IIb). Lipoproteinový typ je však pouze aktuálním obrazem stavu lipidového a lipoproteinového metabolismu. Většina lipoproteinových typů může být způsobena několika genetickými poruchami a naopak některé geneticky podmíněné HLP se mohou projevovat jedním nebo více lipoproteinovými typy v závislosti na dietě nebo medikamentózní léčbě.
Laboratorní hodnoty
norma:
- Celkový cholesterol: < 5 mmol/l
- LDL-cholesterol: < 3 mmol/l
- TAG:< 1,7 mmol/l
- HDL: u muže > 1 mmol/l; u ženy > 1,2 mmol/l
Biochemické vyšetření u hyperlipoproteinémie
Problematika poruch lipidového metabolismu se v posledních letech dostává do popředí zájmu především v souvislosti s prevencí a léčbou kardiovaskulárních onemocnění. Podstatnou úlohu v diagnostice hyperlipoproteinémií a sledování terapie mají biochemická vyšetření.
Základním laboratorním vyšetřením je stanovení celkového cholesterolu a triacylglycerolů v séru (plazmě), dále stanovení LDL- a HDL-cholesterolu.
K dalším již specializovanějším vyšetřením patří stanovení typických apoproteinů apoA-I (HDL) a apoB-100 (LDL), popř. i lipoproteinu(a) a elektroforéza lipoproteinů, jejíž význam se snižuje. Postupně se rozvíjí i DNA diagnostika, postihující příčiny některých HLP.
Laboratorní diagnostika poruch lipidového metabolismu se musí opírat o vyšetření krevních lipidů alespoň ze dvou odběrů krve v rozmezí 2–8 týdnů, za běžného životního stylu. U jednotlivých parametrů se zjistí rozdíly a pokud jsou nižší než přípustné hodnoty, vypočte se aritmetický průměr pro každý analyt. V případě překročení kritického rozdílu mezi 2 po sobě jdoucími analýzami se provede třetí vyšetření.
Kritické rozdíly pro analyty lipidového metabolismu Analyt Kritický rozdíl [%] Celkový cholesterol > 20 LDL-cholesterol > 25 HDL-cholesterol > 25 Triacylglyceroly > 65
Je třeba rovněž vzít v úvahu, že vyšetření lipidového metabolismu je významně ovlivněno životním stylem (dietní návyky, pohybová aktivita, tělesná hmotnost), farmakoterapií (hormonální antikoncepce, hormonální substituční léčba ad.) a probíhajícím akutním nebo nekompenzovaným onemocněním. Proto vyšetření krevních lipidů nemá být prováděno tehdy, kdy lze předpokládat, že výsledek nebude vypovídat o situaci za běžného životního stylu (krátce po dovolené, při hospitalizaci z jiných důvodů, akutním diabetes mellitus, v těhotenství a půl roku po něm atd.).
Stanovení celkového cholesterolu
Princip
Cholesterol je v krevní plazmě transportován jako součást lipoproteinů, z největší části ve frakci LDL, méně v HDL a VLDL. Z tohoto cholesterolu jsou přibližně dvě třetiny esterifikovány vyššími mastnými kyselinami, zbytek je neesterifikován.
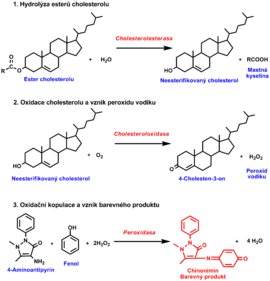
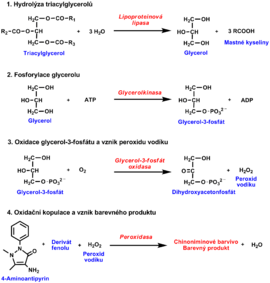
- Běžně je v séru (plazmě) stanovován celkový cholesterol. Proto vlastnímu stanovení celkového cholesterolu předchází hydrolýza esterů cholesterolu na volný cholesterol a mastné kyseliny pomocí enzymu cholesterolesterázy (CE).
- Následuje oxidace neesterifikovaného cholesterolu na 4-cholesten-3-on za současného vzniku peroxidu vodíku v reakci katalyzované cholesteroloxidázou (CHOD).
- Poslední reakce využívá peroxidu vodíku k oxidační kopulaci 4-aminoantipyrinu a fenolu v přítomnosti dalšího enzymu peroxidázy (POD). Vzniká barevný produkt, jehož absorbance je úměrná množství cholesterolu (obr. 2).
Hodnocení
- Se stoupající koncentrací celkového cholesterolu se zvyšuje riziko aterosklerózy. Podle českých a evropských doporučení má být koncentrace celkového cholesterolu < 5,0 mmol/l. Celkový cholesterol by měl být stanoven u všech osob nad 18 let v rámci prevence. Vyšetření by mělo být i v případě normálního výsledku t.j. do 5,0 mmol/l opakováno za 5 let.
- Pokud je koncentrace vyšší a dále u nemocných s ischemickou chorobou srdeční a dalších rizikových osob, přistupujeme k podrobnějšímu vyšetření lipidového spektra stanovením LDL- a HDL cholesterolu a triacylglycerolů.
- U pacientů se zvýšeným rizikem kardiovaskulárního onemocnění (např. diabetici) by celkový cholesterol měl být nižší < 4,5 mmol/l a u osob s již manifestním kardiovaskulárním onemocněním dokonce < 4,0 mmol/l.
- Zvýšená koncentrace cholesterolu se dále často nachází u diabetiků nebo u hypotyreózy. Ke snížení koncentrace celkového cholesterolu dochází např. u pokročilých jaterních cirhóz nebo hypertyreózy nebo malnutrici.
- Je markerem pro celkovou mortalitu a pro KVO rizikovým faktorem. Vztah cholesterolu k celkové mortalitě je nelineární, má tvar písmene J nebo U, který lze vysvětlit mechanismem reverzní kauzality.
Hodnoticí meze
Koncentrace celkového cholesterolu v séru (S-cholesterol celkový): 2,9–5,0 mmol/l.
Stanovení LDL-cholesterolu (LDL-C)
Princip
Koncentraci LDL-cholesterolu lze zjistit nepřímo pomocí výpočtu nebo přímou analýzou.
Nepřímé stanovení LDL-C
- Při nepřímém stanovení LDL-C se používá tzv. Friedewaldův vzorec.
- LDL-cholesterol = celkový cholesterol – HDL-cholesterol – TG/2,2
- Vychází z předpokladu, že cholesterol v séru je obsažen ve frakci HDL, LDL a VLDL. Výpočet vyžaduje měření tří různých analytů – celkového cholesterolu, HDL-cholesterolu a triacylglycerolů. Tím se zvyšuje možnost analytických chyb. Celkový cholesterol a HDL-cholesterol stanovujeme přímo. Zjištění cholesterolu ve VLDL je obtížné. Určujeme ho na základě předpokladu, že molární poměr cholesterolu ve VLDL činí průměrně 45 % obsahu celkových triacylglycerolů; potom zlomek TG/2,2 představuje cholesterol ve VLDL částicích. Vzorec lze použít pouze za předpokladu, že hodnota triacylglycerolů není vyšší než 4,5 mmol/l, nesmějí být přítomna chylomikra.
Přímé stanovení LDL-C
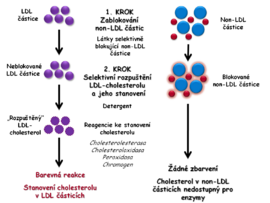
Do praxe se postupně zavádí přímé stanovení LDL-cholesterolu homogenními metodami bez nutnosti separačních kroků a centrifugace, jejichž výhodou je možnost automatizace. Zjednodušení analýzy bylo dosaženo použitím různých detergentů a dalších reagencií, které specificky blokují nebo rozpouštějí jednotlivé lipoproteinové frakce. Tímto způsobem se oddělí LDL částice, v nichž se v závěrečné fázi analýzy určí obsah cholesterolu.
Pro přímé stanovení LDL-C bylo vypracováno několik postupů. Analýza bývá rozdělena do dvou kroků.
- Jeden z postupů využívá různých detergentů a dalších látek k selektivnímu zablokování cholesterolu v non-LDL částicích (HDL, VLDL a chylomikrony), jejichž cholesterol se stává nedostupným pro působení enzymů používaných k jeho stanovení. V neblokovaných LDL-částicích je po uvolnění stanoven cholesterol enzymovou metodou popsanou u celkového cholesterolu pomocí reakcí cholesterolesterázy, cholesteroloxidázy a peroxidázy (Obr. 3A).
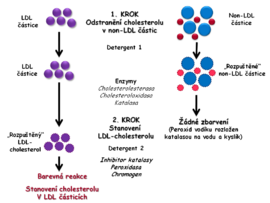
- V jiné metodě je v první fázi pomocí detergentu uvolněn cholesterol z chylomikronů, VLDL a HDL. Uvolněný cholesterol je přeměněn pomocí enzymů až na 4-cholesten-3-on a peroxid vodíku. Peroxid vodíku vzniklý v této fázi není využit k tvorbě barevného produktu, neboť by interferoval v dalším kroku stanovení. Proto je rozložen katalázou na vodu a kyslík. Při této reakci se nevyvíjí zbarvení.Ve druhé fázi jiný detergent uvolní cholesterol z LDL a ten je poté stanoven podobně jako u celkového cholesterolu (Obr. 3B).
Existují i další metody pro stanovení přímého LDL-cholesterolu.
Hodnocení
- Zvýšená koncentrace LDL-cholesterolu se významně podílí na rozvoji aterosklerózy. Doporučená koncentrace LDL-cholesterolu je podle současných českých a evropských doporučení < 3,0 mmol/l.
- Pro pacienty se zvýšeným rizikem kardiovaskulárního onemocnění jsou doporučovány koncentrace LDL < 2,6 mmol/l a pro pacienty s již rozvinutým kardiovaskulárním onemocněním < 1,8 mmol/l.
Hodnoticí meze
LDL-cholesterol v séru: 1,2–3,0 mmol/l
Stanovení HDL-cholesterolu (HDL-C)
Princip
Starší metody pro stanovení HDL-C
Starší metody využívají postupy založené na stanovení cholesterolu v HDL částicích po odstranění non-HDL částic. Vysrážené lipoproteinové částice jsou odděleny centrifugací. V supernatantu je poté stanovena koncentrace cholesterolu v HDL částicích pomocí běžně používaných fotometrických metod.
Přímé stanovení HDL-C
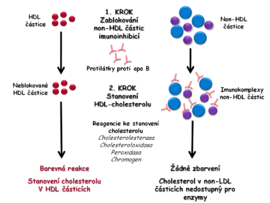
Moderní snadno automatizovatelné metody využívají podobně jako je tomu u LDL-C přímého stanovení HDL-cholesterolu pomocí homogenních metod bez precipitace a centrifugace. Pro přímé stanovení HDL-C bylo vypracováno několik postupů. Analýza bývá rozdělena do dvou kroků.
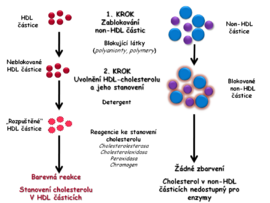
- V prvním kroku jsou blokovány všechny non-HDL částice (VLDL, LDL, chylomikrony). Zablokováním non-HDL částic se znemožní reakce v nich obsaženého cholesterolu s enzymy používanými k jeho stanovení. Blokace může být dosaženo imunoinhibicí pomocí protilátek namířených proti apoB, který je součástí VLDL, LDL i chylomikronů. Protilátky vytvářejí s non-HDL rozpustné imunokomplexy. V dalším kroku detergent rozpustí HDL částice a pomocí enzymů cholesterolesterázy, cholesteroloxidázy a peroxidázy je měřen cholesterol v HDL stejným způsobem jako při stanovení celkového cholesterolu, tj. pomocí enzymů (obr. 4A).
- Další metoda používá k blokaci polyaniontů a polymerů, které se selektivně adsorbují na povrch non-HDL lipoproteinům. Ty jsou potom chráněny vůči detergentům, které uvolňují cholesterol obsažený pouze v HDL částicích. Druhý krok analýzy je analogický postupu popsanému u první metody (obr. 4B).
Hodnocení
- Koncentrace HDL-cholesterolu by měly být > 1,0 mmol/l u mužů a > 1,2 mmol/l u žen. Zvýšený HDL-C je považován za „negativní rizikový“ faktor rozvoje aterosklerózy a naopak hladiny nižší než 1,0 mmol/l jsou spojovány se zvýšeným rizikem aterosklerózy.
- Nízký HDL provází metabolický syndrom, nízkou tělesnou aktivitu, DM 2.typu, kuřáctví cigaret a konzumaci velkého množství sacharidů.
Hodnoticí meze
- HDL-cholesterol v séru (muži): 1,0–2,1 mmol/l
- HDL-cholesterol v séru (ženy): 1,2–2,7 mmol/l
Stanovení triacylglycerolů
Princip
Doporučené rutinní metody stanovení triacylglycerolů využívají několika enzymových reakcí.
- Lipoproteinová lipáza katalyzuje hydrolýzu triacylglycerolů na glycerol a mastné kyseliny.
- Uvolněný glycerol se převádí působením glycerolkinázy v přítomnosti ATP na glycerol-3-fosfát, který je pomocí glycerol-3-fosfátoxidázy oxidován na dihydroxyacetonfosfát.
- Současně vzniklý peroxid vodíku je využíván v další reakci katalyzované peroxidázou k oxidační kopulaci 4-aminoantipyrinu s derivátem fenolu. Vzniká chinoniminové barvivo, jehož absorbance se odečítá.
Hodnocení
- Zvýšená koncentrace triacylglycerolů je nezávislým rizikovým faktorem aterosklerózy. Česká a evropská doporučení považují za normální koncentraci triacylglycerolů v séru hodnotu < 1,7 mmol/l.
- Koncentrace TG > 1,7 mmol/l (nalačno) je považována za ukazatel zvýšeného kardiovaskulárního rizika. Vyšší triacylglyceroly bývají spojené se sníženými hladinami HDL a předpovídají vysoké koncentrace remnantů bohatých na cholesterol a malých hustých částic LDL typu B.
- Koncentrace triacylglycerolů se zvyšuje během 2 hodin po jídle a maxima dosahuje za 4–6 hodin, proto musí být krev na stanovení triacylglycerolů odebírána po 12–14 hodinovém lačnění. Vzorky plazmy s koncentrací TG vyšší než 3,4 mmol/l opaleskují, při hladinách TG nad 11,3 mmol/l jsou přítomny chylomikrony a plazma je mléčně zakalená.
- Při terapii se klade velký důraz na dietu s nízkým obsahem tuků a cukrů, na zvýšenou tělesnou aktivitu, dostatek antioxidantů v potravě a na celkovou hypolipidemickou léčbu.
Hodnoticí meze
Koncentrace triacylglycerolů v séru (fS-triacylglyceroly): 0,45–1,7 mmol/l
Odvozené parametry lipidového metabolismu
Cílem těchto výpočtů je zpřesnit stanovení rizika, které vyplývá z naměřených hodnot krevních lipidů.
Aterogenní index
- Z naměřených hodnot týkajících se cholesterolu lze počítat různé aterogenní indexy. Doručován je index, který bere v úvahu vliv koncentrace celkového cholesterolu i HDL-C na riziko kardiovaskulárních onemocnění. Index zohledňuje fakt, že zvýšený HDL-C je „negativní rizikový faktor“, snižující riziko ischemické choroby srdeční (ICHS). Současné zvýšení celkového i HDL cholesterolu nemusí riziko ICHS zvyšovat.
- Celkový cholesterol/HDL-cholesterol
Doporučená hodnota
Aterogenní index: < 5,0
Non-HDL-cholesterol
- Je využíván k odhadu rizika aterosklerózy v případech, kdy není možno vypočítat koncentraci LDL-C. Představuje cholesterol obsažený v potenciálně aterogenních lipoproteinových částicích (LDL, IDL, VLDL, zbytkové chylomikrony).
- Non-HDL-cholesterol (mmol/l) = celkový cholesterol (mmol/l) – HDL-cholesterol (mmol/l)
Doporučená hodnota
Non-HDL-cholesterol: < 3,8 mmol/l
Chylomikronový test
Princip:
- Měření koncentrace chylomikronů není běžně prováděno. Ve vzorcích odebraných po 12 hodinovém lačnění by se neměly vyskytovat. Pro jejich přítomnost svědčí silná chylozita séra. K důkazu lze provést chylomikronový test, který spočívá v pozorování opalescentního až bílého prstence po 12ti hodinovém stání séra při 4 °C. Během této doby flotují eventuálně přítomné chylomikrony k hladině vzorku. Každé zdravé sérum má být po 12 hodinovém lačnění úplně čiré.
- Vzhled séra při chylomikronovém testu může upozornit i na jiné poruchy v metabolismu lipoproteinů.
Hodnocení
| Vzhled | Změny v lipoproteinech |
|---|---|
| Čirý | normální sérum nebo zvýšeny LDL částice |
| Mléčně zkalená horní vrstva, sérum pod touto vrstvou je čiré | mléčně zkalená horní vrstva odpovídá chylomikronům, které během inkubace vyplavou na povrch |
| Difúzní zkalení celého vzorku (chylózní sérum) | zvýšeny VLDL částice, intenzita zákalu závisí na množství triacylglycerolů ve VLDL |
| Mléčně zkalená horní vrstva a difúzní zkalení infranatantu | zvýšeny chylomikrony a VLDL |
| Úzká krémovitá horní vrstva a difúzní zkalení infranatantu | zvýšení chylomikronových zbytků a IDL |
Elektroforéza sérových lipoproteinů
Princip
- Lipoproteinové částice se dělí v elektrickém poli podle rozdílné velikosti povrchového náboje, v tomto případě podmíněného rozdílným množstvím bílkovin v jednotlivých frakcích. Využívá se především pro průkaz některých abnormálních lipoproteinů a při diagnostice méně častých typů hyperlipoproteinémií a pro detekci aterogenního lipoproteinu Lp (a).
- Nejrychleji v oblasti α se pohybují nejmenší částice s nejvyšším obsahem proteinů α-lipoproteiny (HDL). Na úrovni mezi α-2 a β jako pre-β-lipoproteiny migrují VLDL částice. LDL částice představují obvykle nejvýraznější frakci jako β-lipoproteiny v oblasti β-globulinů. Chylomikrony, pokud jsou přítomny v séru, zůstávají na startu, někdy mohou vytvářet pruh, který je viditelný od místa startu až k α oblasti. V poloze mezi α a β-lipoproteiny (HDL a LDL) se může objevit další frakce charakteristická pro lipoprotein (a) – Lp(a), který představuje rizikový faktor pro vznik aterosklerózy a kardiovaskulárních onemocnění.
- Provedení elektroforézy sérových lipoproteinů je obdobné jako u elektroforézy sérových bílkovin s tím rozdílem, že k barvení se používají lipofilní barviva např. Sudanová čerň. Elektroforéza lipoproteinů se obvykle provádí na agarosovém gelu, který umožňuje dobré oddělení pre-β-lipoproteinů.
Hodnocení
- Elektroforeogram lze vyhodnotit denzitometricky při vlnové délce 580 nm. Výsledek se vyjadřuje v procentech optické hustoty pro jednotlivé frakce vzhledem k celkové barevné ploše. Stanovené hodnoty spolu s dalšími ukazateli (celkový cholesterol, triacylglyceroly) slouží k charakterizaci hyperlipoproteinémií (Obr. 7, 8, 9).
- V praxi se provádí také hodnocení pouze vizuální. Biologický nález se srovnává s referenčními hodnotami a výsledek se posuzuje ve smyslu zvýšení (snížení) jednotlivých frakcí.
| Referenční hodnoty | |
|---|---|
| α-lipoproteiny | 23–46 % |
| pre-β-lipoproteiny | 3–18 % |
| β-lipoproteiny | 42–63 % |
Odkazy
Související články
Použitá literatura
- BURTIS, C.A. a E.R ASHWOOD. Tietz Textbook of Clinical Biochemistry. 2. vydání. Philadelphia : W.B.Saunders Company, 1994. ISBN 0-7216-4472-4.
- ČEŠKA, R., et al. Cholesterol a ateroskleróza, léčba dyslipidémií. 1. vydání. Praha : Triton, 2005. ISBN 80-7254-738-0.
- MASOPUST, J. Klinická biochemie. Požadování a hodnocení biochemických vyšetření I. a II. část. 1. vydání. Praha : Karolinum, 1998. ISBN 80-7184-650-3.
- RACEK, J., et al. Klinická biochemie. První vydání. Praha : Galén – Karolinum, 1999. ISBN 80-7262-023-1.
- SCHNEIDERKA, P., et al. Kapitoly z klinické biochemie. 2. vydání. Praha : Karolinum, 2004. ISBN 80-246-0678-X.
- SOŠKA, V. Poruchy metabolismu lipidů. Diagnostika a léčba. 1. vydání. Praha : Grada Publishing, 2001. ISBN 80-247-0234-7.
- ŠTERN, P., et al. Obecná a klinická biochemie pro bakalářské obory studia.. 1. vydání. Praha : Karolinum, 2005. ISBN 978-80-246-1025-2.
- TÁBORSKÁ, E., et al. Biochemie II – Praktická cvičení. 3. vydání. Brno : Masarykova universita, 1999. ISBN 978-80-210-4516-3.
- ZIMA, T., et al. Laboratorní diagnostika. 1. vydání. Praha : Galén – Karolinum, 2002. ISBN 80-7262-201-3.
- FIALOVÁ, L. a M VEJRAŽKA. Vybraná biochemická vyšetření u pacientů s poruchami metabolismus lipidů [online]. ©2005. Poslední revize 20. 3. 2008, [cit. 7. 9. 2009]. <https://el.lf1.cuni.cz>.
- VEVERKOVÁ, H., et al. Doporučení pro diagnostiku a léčbu dyslipidemií v dospělosti, vypracované výborem České společnosti pro aterosklerózu [online]. ©2005. Poslední revize 9. 3. 2007, [cit. 7. 9. 2009]. <http://www.athero.cz/user_data/zpravodajstvi/obrazky/File/Doporuceni%20CSAT-07.pdf>.