Obecná struktura enzymů
V biologických systémech probíhá mnoho různých reakcí. Při pokusech se zjistilo, že rychlost těchto reakcí je při provedení mimo živý systém (tj. in vitro) mnohem nižší než in vivo. V živých systémech probíhají reakce stokrát až milionkrát rychleji než in vitro. Způsobují to specifické katalyzátory – enzymy. Ty často umožňují průběh i takových reakcí, které by jinak v podmínkách lidského těla (teplota, pH atd.) prakticky neprobíhaly.
Biologické katalyzátory[upravit | editovat zdroj]
Katalyzátor je látka, která zvyšuje rychlost chemické reakce, ale nemění chemickou rovnováhu (jen zkracuje čas jejího dosažení). Při reakcích se molekula enzymů nespotřebovává.
Enzym[upravit | editovat zdroj]
Enzym je specifická organická molekula urychlující reakce v organismech (působí jako biokatalyzátor). Umožňuje tak průběh reakcí i při relativně nízkých teplotách, neutrálním pH a atmosférickém tlaku, které se v organismech běžně vyskytují. Naprostá většina enzymů jsou proteiny. Výjimku tvoří některé druhy RNA molekul – tzv. ribozymy.
Vedle bílkovinné složky mohou enzymy obsahovat i nebílkovinnou součást. Podle její přítomnosti lze enzymy dělit na:
Kofaktory[upravit | editovat zdroj]
Kofaktorem mohou být :
- ionty kovů: Zn2+ (např. alkoholdehydrogenáza), Mn2+ (např. argináza), Fe2+, Cu2+, Mg2+,
- organické molekuly: často se jedná o deriváty vitaminů.
Podle charakteru vazby na apoenzym kofaktory dělíme na:
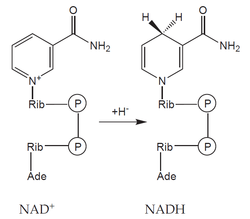
- koenzymy: organická molekula neproteinové povahy, na molekulu apoenzymu vázaná volně – může se z něho oddělit (např. NAD+, NADP+),
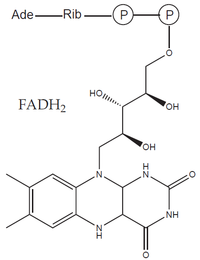
- prostetické skupiny: organická molekula neproteinové povahy, na molekulu apoenzymu vázaná pevně (např. hem, FAD).
Multienzymový komplex[upravit | editovat zdroj]
Enzym může být tvořen různým počtem peptidových řetězců. Každý řetězec může obsahovat více domén (se stejnou či rozdílnou enzymovou specificitou). Pokud enzym obsahuje více řetězců (kvarterní struktura), označujeme jej jako multienzymový komplex. Jednotlivé podjednotky mívají obvykle různou specificitu a bývají vzájemně spojeny nekovalentně. Jako příklad multienzymového komplexu lze uvést syntázu mastných kyselin, která katalyzuje syntézu vyšších mastných kyselin v buňkách.
Zymogeny[upravit | editovat zdroj]
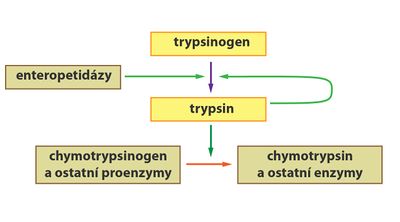
Některé enzymy (např. trávicí) jsou tvořeny a sekretovány ve své neaktivní podobě jako tzv. zymogeny (proenzymy). Důvodem je ochrana syntetizujících buněk před štěpením účinkem aktivních forem enzymů. Zymogeny jsou aktivovány až na místě, kde se jejich aktivita požaduje. Aktivace může například probíhat jako tzv. parciální proteolýza, během níž se odštěpí přesně definovaná část molekuly proenzymu.
Uvedeme si dva příklady tohoto procesu:
- Hlavní buňky žaludeční sliznice sekretují proenzym pepsinogen. HCl přítomná v žaludeční šťávě napomáhá autoaktivaci pepsinogenu na aktivní pepsin. Reakce probíhá také autokatalyticky, kdy se na štěpení pepsinogenu podílejí již vytvořené molekuly pepsinu.
- Podobně jako pepsin je i trypsin syntetizován v pankreatu jako inaktivní trypsinogen. V tenkém střevě je následně pomocí enzymu enteropeptidázy (tvořené buňkami sliznice střeva) odštěpen hexapeptid za vzniku aktivního trypsinu.