Odměrná analýza
Odměrná analýza (též titrační stanovení, titrace) patří obecně mezi kvantitativní metody, které se zabývají stanovením množství jednotlivých složek ve zkoumaném (analyzovaném) materiálu (vzorku), které byly již předem určeny kvalitativní analýzou, zjišťující pouze složení analyzovaného vzorku.
Odměrná analýza se provádí v kapalném prostředí, patří mezi přímé chemické metody analýzy vedle instrumentálních analytických metod, které využívají ke kvantitativnímu stanovení nepřímých fyzikálně-chemických měření.
Odměrná analýza využívá ke kvantitativnímu stanovení stechiometrických analytických reakcí. Podmínkou je, aby takovéto reakce probíhaly jednoznačně, dostatečně rychle, bez rušivých vedlejších reakcí a kvantitativně, s možností snadno identifikovat konec reakce, dosažení bodu ekvivalence.
Principem titrace je přesné měření objemu roztoku odměrného (titračního) činidla, které postupně přidáváme (z byrety) k přesně známému objemu roztoku analyzovaného vzorku (v titrační baňce) až do okamžiku, kdy mezi nimi proběhne kvantitativně chemická reakce (bod ekvivalence). Podle stechiometrických poměrů chemické rovnice proběhlé reakce, z naměřeného objemu titračního činidla spotřebovaného při titraci, z jeho koncentrace a z objemu roztoku analyzovaného vzorku vypočítáme ekvivalentní množství analyzované látky v objemu analyzovaného vzorku nebo přímo jeho koncentraci.
Titrace se mohou provádět jako:
- Přímá titrace, kdy se přidává odměrný roztok přímo k roztoku stanovované látky až do okamžiku, kdy jsou si látková množství obou roztoků ekvivalentní.
- Nepřímá titrace, kdy se k roztoku stanovované látky přidá nadbytek činidla, vytvoří se produkt, který se teprve titruje.
- Zpětná titrace, kdy se přidá k roztoku stanovované látky přesný objem odměrného činidla v nadbytku, nechá se proběhnout kvantitativní reakce, poté se nadbytek odměrného činidla titruje dalším odměrným činidlem.
Metody odměrné analýzy
Metody odměrné analýzy se dělí podle principu chemických reakcí, které jsou podstatou titračního stanovení, na:
- acidobazické titrace (stanovení kyselých, respektive zásaditých látek titrací zásadami, resp. kyselinami), principem jsou neutralizační reakce
- H3O+ + OH- 2 H2O
- komplexotvorné (titrace, kdy kation stanovovaného kovu je vázán do rozpustného komplexního iontu, takže z roztoku jako volný kation vymizí), viz komplexní sloučeniny.
- srážecí (titrace založené na vzniku málo rozpustných sloučenin, titrovaná látka vymizí z roztoku, protože je z něj vysrážena), viz součin rozpustnosti. Např. argentometrie, která využívá tvorby nerozpustných solí s kationtem Ag+, titračním činidlem je AgNO3, vhodná pro stanovení Cl-, Br-, I-, CN-, SCN- aj.
- oxidačně-redukční (titrovaná látka je zoxidována nebo zredukována oxidujícím, resp. redukujícím titračním činidlem)
Jednotlivé typy titrací se také někdy nazývají podle charakteru roztoku titračního činidla (alkalimetrie – používáme odměrný roztok zásady, acidimetrie – používáme odměrný roztok kyseliny, manganometrie – titrujeme odměrným roztokem KMnO4 aj.). Pokud se konec titrace zjišťuje některou z instrumentálních indikací, pak se tato objevuje v názvu titrace, např. potenciometrická, konduktometrická titrace.
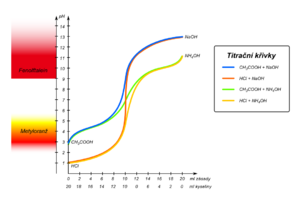
Titrační křivky
Při acidobazických (neutralizačních) titracích ve vodných roztocích se během titrace kyselin zásadami nebo naopak, mění v titrovaném roztoku koncentrace vodíkových iontů podle charakteru probíhajících rovnovážných reakcí titrovaných látek a titračních činidel. pH lze vypočítat z jejich disociačních konstant a iontového produktu vody, nebo jej můžeme měřit pH-metrem v celém průběhu titrace (návod). Grafickým znázorněním závislosti změn pH na množství přidávaného titračního činidla dostaneme titrační křivku. Např. titrujeme-li roztok silné kyseliny silnou zásadou nebo naopak, vzniká postupně její sůl až do okamžiku, kdy v titrovaném roztoku v bodu ekvivalence bude neutrální sůl, pH bude 7. V případě titrace slabé kyseliny silnou zásadou v důsledku hydrolýzy soli bude pH bodu ekvivalence posunuto směrem k vyšší hodnotě pH, v případě titrace slabé zásady silnou kyselinou analogicky k nižším hodnotám pH. Ze závislostí je zřejmé, že v bodu ekvivalence nastává největší změna pH, čehož se využívá již ve zmíněné indikaci bodu ekvivalence acidobazických chemických reakcí při titracích. Např. z naměřených závislostí je zřejmý také rozdíl mezi titrační a skutečnou (aktuální) aciditou slabé kyseliny, titrační acidity jsou pro silnou i slabou kyselinu přibližně stejné, jsou-li stejně sytné a o stejné koncentraci, zatímco aktuální aciditou se liší. Dále pak můžeme z těchto závislostí odečíst pK slabých kyselin i zásad.
Určení bodu ekvivalence, indikátory
Jako bod ekvivalence se v chemii označuje konec titrace – stav, kdy látkové množství titračního činidla (jeho látková koncentrace vynásobená spotřebovaným objemem při titraci) je ekvivalentní látkovému množství stanovované látky.
Způsoby indikace bodu ekvivalence
- Vizuální indikace – subjektivně pozorovatelná změna titrovaného roztoku vzorku, změna barvy, vznik sraženiny, fluorescence. Nejčastěji je to změna barvy vhodného barviva, indikátoru, přidaného do titrovaného roztoku, ke které dojde právě při dosažení bodu ekvivalence.
- Instrumentální indikace – měřená přístroji, kdy se měří některá z fyzikálních veličin titrovaného roztoku (např. vodivost roztoku, pH atd.) v závislosti na objemu přidávaného titračního činidla – opět titrační křivka. Veličina je vybrána tak, aby v bodu ekvivalence došlo k podstatné změně na této křivce (např. zlom), takže z určitého bodu této změny určíme spotřebu titračního činidla.
Indikátory jsou látky, které reagují buď se stanovovanou látkou nebo s přebytečným titračním činidlem a forma zreagovaná a nezreagovaná mají různé barvy. V bodu ekvivalence pak dochází k přeměně jedné formy na druhou. Jsou to látky podobné povahy jako titrační činidlo nebo titrovaná látka. Podle charakteru titrací, existuje celá řada různých druhů indikátorů.
Indikátory acidobazické (pro titrace kyselin a zásad). Jsou to slabé organické kyseliny nebo zásady. Forma kyselá (HInd), která existuje při vyšší koncentraci H+ (nižším pH) má jinou barvu než forma zásaditá (Ind-). Indikátorová kyselina a zásada tvoří spolu konjugovaný pár s ionizační konstantou KHInd.
- HInd H+ + Ind-
Podle koncentrace iontů titrovaného roztoku se ustaluje poměr koncentrací obou forem – protolytická rovnováha
Matematickou úpravou (záporným zlogaritmováním těchto vztahů) dostaneme výraz
Při titračním stanovení, např. kyseliny odměrným zásaditým roztokem, je v titrovaném roztoku forma kyselá. Přímo v bodu ekvivalence jsou vlastně přítomny obě formy. Těsně za bodem ekvivalence kyselá forma zcela vymizí (zreaguje s přebytkem zásaditého titračního činidla na formu zásaditou). Z toho je zřejmé, že se barva indikátoru obvykle postupně mění v určitém malém rozmezí kolem bodu ekvivalence. Poměr log HInd/Ind- může nabývat během titrace hodnot přibližně od −1 do +1, proto rozmezí pH barevných přechodů acidobazických indikátorů (funkční oblast) bývá do 2 jednotek pH.
Příklady acidobazických indikátorů:
- Methyloranž, funkční oblast pH 3,0–4,4; červená – oranžová;
- 4-[4-(dimethylamino) fenylazo]benzen-sulfonát sodný
- Methylčerveň, funkční oblast pH je 4,4–6,2; červená – žlutá;
- 2-(4-dimethylaminofenylazo)benzoová kyselina
- Fenolová červeň, funkční oblast pH je 6,8–8,4; žlutá – červená;
- Fenolsulfoftalein, 3,3-bis(4-hydoxyfenyl)-sulfoftalid
- Fenolftalein, funkční oblast pH je 8,2–10,0; bezbarvá – červenofialová;
- 3,3-bis(4-hydroxyfenyl)-1(3H)-isobenzofuranon
Indikátory komplexometrických titrací – metalochromní, jsou látky tvořící komplex se stanovovaným iontem kovu. Komplex s kovem je odlišně zbarvený než forma volného indikátoru. Před bodem ekvivalence je přítomna jen forma komplexu s kovem. Těsně před bodem ekvivalence, kdy se již v roztoku nedostávají volné ionty stanovovaného kovu, začne komplexující titrační činidlo reagovat s iontem kovu, který byl vázán do komplexu s indikátorem, a tím vytěsňuje indikátor ve volné formě.
Příklady metalochromních indikátorů: eriochromová čerň T (přechází z fialové na modrou), xylenolová oranž (z červené či fialové na žlutou), murexid (ze žluté či červené na fialovou).
Indikátory srážecích titrací tvoří těsně za bodem ekvivalence s prvním přebytkem titračního činidla barevné sraženiny popř. rozpustné barevné komplexy, nebo mohou v důsledku adsorpce na částicích sraženiny či naopak desorpce způsobovat změnu zbarvení sraženiny nebo roztoku v bodě ekvivalence (viz argentometrie, součin rozpustnosti).
Indikátory redoxních reakcí. Používají se velmi často látky, jejichž redukovaná forma je barevně odlišná od oxidované formy. První přebytek oxidujícího titračního činidla těsně za bodem ekvivalence převede redukovanou formu na formu oxidovanou, (příklady benzidin nebo difenylamin – přecházejí z bezbarvé na modrou). Řada redoxních indikátorů funguje nevratně, jako některé z barevných látek (např. methylčerveň), které se prvním přebytkem oxidačního činidla zoxidují, což má za následek rozklad látky, projeví se to odbarvením. Redukcí však už nelze získat zpět redukovanou barevnou formu.
Související články
Příprava odměrných (titračních) činidel
Roztok odměrného činidla můžeme připravit o přesné koncentraci buď přesným odvážením látky, rozpuštěním a doplněním vodou po rysku v odměrné baňce, pokud je látka stálá, standardní a chemicky čistá. Častější způsob přípravy je, že se připraví odměrný roztok o přibližné koncentraci a ztitruje se jím přesný objem standardního roztoku o přesné koncentraci, jakou by měl mít odměrný roztok – tzv. standardizace titračních roztoků. Tímto postupem stanovíme titrační faktor f odměrného činidla jako poměr objemu teoretické spotřeby odměrného roztoku v ml a skutečné spotřeby odměrného roztoku v ml. Titračním faktorem pak při výpočtu koncentrací látek z titračního stanovení upravujeme (násobíme) látkovou koncentraci titračního činidla.
- Je-li roztok o přesné koncentraci, f = 1.
- Je-li roztok zředěnější, f je menší než 1.
- Je-li roztok koncentrovanější, f je větší než 1.
Související články
Vlastní titrace
Byreta se propláchne destilovanou vodou a nalije se do ní pomocí nálevky odměrné činidlo o známé koncentraci. Do čisté titrační baňky se přesně odměří objem roztoku analyzované látky (vzorku) a přidá se několik kapek vhodného indikátoru. Titrační baňkou se krouživě pohybuje a současně se opatrně odpouští z byrety postupně malé množství odměrného roztoku. Před koncem titrace, tj. když začíná být patrná změna titrovaného roztoku (barva, zákal aj.), přidáváme titrační činidlo velmi pomalu (po kapkách), až do trvalé změny titrovaného roztoku. Titruje se celkem třikrát. První titrace je orientační, slouží k vyzkoušení barevného přechodu indikátoru či jiných změn, (snadno se „přetitruje“, tj. spotřebuje se větší objem odměrného činidla). Průměrná spotřeba druhé a třetí titrace se použije pro výpočet koncentrací. Barevný roztok se lépe pozoruje proti bílému pozadí, vznikající bílý zákal naopak proti černému pozadí.
Výpočet látkové a hmotnostní koncentrace z titračního stanovení
Při výpočtu koncentrací látek stanovovaných titrací, vycházíme ze stavu, kdy proběhla ve stechiometrickém poměru kvantitativně chemická reakce, a v bodu ekvivalence jsou sobě rovny ekvivalentní látková množství odměrného činidla a titrované látky. Reaguje-li s X moly titračního činidla Y molů titrované látky v roztoku, pak obecně platí rovnice
a dosadí-li se za látkové množství n součin koncentrace a objemu, pak platí vztah
| kde označuje | nx | látkové množství látky x (titrační činidlo) |
| ny | látkové množství látky y (titrovaná látka) | |
| X | počet reagujících molekul látky x | |
| Y | počet reagujících molekul látky y | |
| cx | koncentrace látky x | |
| cy | koncentrace látky y | |
| Vx | objem roztoku látky x | |
| Vy | objem roztoku látky y |
Příklad
Na titraci 10 ml roztoku NaOH bylo spotřebováno 8 ml kyseliny sírové o přesné koncentraci c = 0,1 mol/l. Jaká bude látková a hmotnostní koncentrace titrovaného roztoku NaOH?
Řešení
Pro titraci platí chemická rovnice
- H2SO4 + 2 NaOH Na2SO4 + 2 H2O
titrační činidlo H2SO4 (X = 1 mol), titrovaná látka NaOH (Y = 2 moly).
Úpravou výše uvedenéhoztahu dostaneme
Po dosazení
Látková koncentrace NaOH je cy = 0,16 mol/l.
Přepočet na hmotnostní koncentraci: (Mr NaOH = 40)
hmotnostní koncentrace NaOH je w = 6.4 g/l.
Odkazy
Použitá literatura
- Karlíček R. a kolektiv (2001): Analytická chemie pro farmaceuty. Karolinum, Nakladatelství Univerzity Karlovy.
- Kraml J. a kolektiv (1999): Návody k praktickým cvičením z lékařské chemie a biochemie. Karolinum, Nakladatelství Univerzity Karlovy.
- Návod k použití laboratorního pH/mV/ORC-metru Orion 2 Star


![{\displaystyle K_{HInd}={\frac {[H^{+}]\cdot [Ind^{-}]}{[HInd]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/158cc7793b32f9a4fbb0ea01be836d164d5944af)
![{\displaystyle {\frac {[Ind^{-}]}{[HInd]}}={\frac {K_{HInd}}{H^{+}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/5875863865c25f5d25e7d7167cf585e4e5db4e13)
![{\displaystyle pH=pK_{HInd}-log{\frac {[HInd]}{[Ind^{-}]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/b8f5053423e2f0dcfa7f0641178c20a5e755b032)






