Pentózový cyklus, metabolismus fruktózy, galaktózy a kyseliny glukuronové
Náplň podkapitoly:
- Pentózový cyklus (hexózamonofosfátový zkrat)
- Metabolismus fruktózy
- Metabolismus galaktózy
- Přeměna glukózy na kyselinu glukuronovou a její využití
Pentózový cyklus
Pentózový cyklus umožňuje přímou oxidaci glukózy na CO2 bez zahrnutí Krebsova cyklu a dýchacího řetězce.
Jako kofaktor dehydrogenáz se v pentózovém cyklu využívají molekuly koenzymu NADP+, jež se po přijetí redukčních ekvivalentů (atomů H) redukují na NADPH + H+. Ty se mohou v buňce uplatnit na mnoha místech − slouží jako zdroje redukčních ekvivalentů při biosyntézách (např. syntéza mastných kyselin nebo steroidních látek), napomáhají antioxidační ochraně buněk (mj. systém glutathionu), či se účastní metabolismu cizorodých látek.
V pentózovém cyklu může dále vznikat ribóza-5-P (prekurzor při syntéze nukleových kyselin) či mnoho jiných monosacharidů.
Účelem pentózového cyklu není přímý zisk energie, protože NADPH se nemůže oxidovat v dýchacím řetězci, ale spíše:
- 1) zisk NADPH – pentózový cyklus je hlavním producentem NADPH v buňce;
- 2) zisk ribóza-5-P;
- 3) vzájemné přeměny monosacharidů, užité např. při syntéze glykoproteinů.
Pentózový cyklus je lokalizován v cytosolu (zejména buněk jater, tukové tkáně, varlat, kůry nadledvin, dále pak v erytrocytech či v laktující mléčné žláze, enzymy se ale vyskytují ve všech tkáních).
V rámci pentózového cyklu můžeme rozlišit dvě základní fáze – oxidační a neoxidační (regenerační).
Oxidační (oxidativní) fáze
Pentózový cyklus je katabolický děj, který poskytuje redukované kofaktory NADPH a pětiuhlíkaté sacharidy neboli pentózy. Jedná se o metabolickou přeměnu glukózy, jejímž cílem není vytvoření ATP.
Průběh oxidativní fáze pentózového cyklu
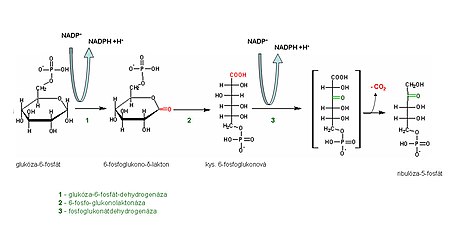
Během oxidativní fáze pentózového cyklu dochází k oxidaci molekuly glukózy-6-P na molekulu ribulóza-5-P. Současně se uvolňuje CO2 a získají se dvě molekuly NADPH + H+.
Její průběh souhrnně zachycuje následující rovnice:
Glukóza-6-fosfát + 2 NADP+ → CO2 + 2 NADPH+H+ + ribulóza-5-fosfát
Z reakcí první fáze je důležitá úvodní reakce katalyzovaná glukóza-6-fosfátdehydrogenázou. Tato nevratná reakce je totiž hlavním regulačním krokem pentózového cyklu.
Rychlost oxidativní fáze pentózové cyklu
Rychlost celé metabolické dráhy se odvíjí od činnosti dvou dehydrogenačních reakcí, které závisejí na dostupnosti NADP+ (tedy oxidované formy koenzymu). Při nedostatku NADP+ rychlost pentózového cyklu klesá, jinými slovy: nadbytek NADPH zpomaluje oxidativní fázi pentózového cyklu.
Regenerační (neoxidační) fáze
Pentózový cyklus je katabolický děj, který poskytuje redukované kofaktory NADPH a pětiuhlíkaté sacharidy neboli pentózy. Jedná se o metabolickou přeměnu glukózy, jejímž cílem není vytvoření ATP.
Průběh regenerační fáze pentózového cyklu
V regenerační fázi dochází k vzájemným přeměnám fosforylovaných molekul monosacharidů.
Tyto reakce jsou volně reverzibilní (vratné).
Základní schéma
Základní schéma regenerační fáze pentózového cyklu bychom mohli zjednodušeně zapsat jako:
- 3 C5 → 2 C6 + C3
- 3 Ribulóza-5-P → 2 fruktóza-6-P + glyceraldehyd-3-P
Detailnější schéma
Při detailnějším pohledu:
- 1) Přeměna ribulóza-5-P na ribóza-5-P (ketóza se mění pomocí izomerázy na aldózu) či na xylulózu-5-P (katalyzuje epimeráza)
- 2) Následuje dvojice reakcí vyjádřená rovnicemi:
- C5 + C5 ↔ C3 + C7 ↔ C6 + C4
- Xylulóza-5-P + ribóza-5-P ↔ glyceraldehyd-3-P + sedoheptulóza-7-P ↔ Fru-6-P + erytróza-4-P
- Tyto reakce katalyzují dvě transferázy – transketoláza a transaldoláza.
- Transketoláza transportuje dvouuhlíkaté jednotky z xylulóza-5-P (ketóza) na ribóza-5-P za vzniku glyceraldehyd-3-P a sedoheptulóza-7-P (kofaktorem enzymu je derivát vitaminu B1 – thiamindifosfát).
- Transaldoláza přenáší tříuhlíkaté jednotky ze sedoheptulóza-7-P (ketóza) na aldehydovou skupinu glyceraldehyd-3-P.
- Obecně platí, že uhlíkaté štěpy (C3- a C2-jednotky) vznikají z ketóz a jejich příjemcem se stávají aldózy.
- Obecně platí, že uhlíkaté štěpy (C3- a C2-jednotky) vznikají z ketóz a jejich příjemcem se stávají aldózy.
- Výsledkem je, že z ketózy vznikne kratší aldóza a z aldózy delší ketóza.
- 3) Aby se nehromadila nepotřebná erytróza-4-P, následuje její reakce s xylulóza-5-P:
- C4 + C5 → C3 + C6
- Erytróza-4-P + xylulóza-5-P → glyceraldehyd-3-P + fruktóza-6-P
Výsledné produkty druhé fáze, fruktóza-6-P a glyceraldehyd-3-P, mohou být reakcemi glykolýzy a glukoneogeneze (probíhají také v cytoplazmě) buď spáleny, nebo přeměněny na glukóza-6-P. Ta může opět vstoupit do oxidativní fáze cyklu, a pentózový cyklus se tedy uzavírá. Na tomto místě jasně vidíme, jak se glykolýza/glukoneogeneze úzce propojuje s pentózovým cyklem.
Někdy se dokonce můžeme setkat s tvrzením, že pentózový cyklus je jejich odbočkou.
Pohlížíme-li na pentózový cyklus jako na alternativní cestu oxidace glukózy, můžeme napsat sumární rovnici:
- 6 Glukóza-6-P → 6 CO2 + 6 ribulóza-5-P + 12 NADPH+H+
- 6 Ribulóza-5-P →→→ regenerační fáze a glukoneogeneze →→→ 5 glukóza-6-P
K tomuto dochází, pokud buňka potřebuje maximalizovat zisk NADPH.
Pentózový cyklus může ale také sloužit jako zdroj ribóza-5-P či jiných monosacharidů. Jestli je buňka potřebuje (a nevyžaduje NADPH), může dojít k otočení druhé fáze cyklu a opačným sledem reakcí se z glykolýzy naopak odčerpává glyceraldehyd-3-P a fruktóza-6-P a postupně se mění na ribóza-5-P či ostatní monosacharidy.
Regulace pentózového cyklu
Jak již zaznělo výše, pentózový cyklus je regulován na úrovni dostupnosti koenzymu NADP+. Není-li vznikající redukovaná forma NADPH odčerpávána a reoxidována v jiných metabolických procesech, dochází k inhibici reakcí, které vyžadují oxidovanou formu tohoto koenzymu. Redukci NADP+ na NADPH katalyzuje glukóza-6-fosfátdehydrogenáza a 6-fosfoglukonátdehydrogenáza. Syntézu klíčových enzymů rovněž indukuje inzulin. Prolaktin činí totéž během laktace.
Deficit glukózo-6-fosfátdehydrogenázy se považuje za celosvětově nejrozšířenější enzymatický defekt – počet postižených se odhaduje na 400 miliónů osob (převážně v Africe, Středomoří, Středním východě a v Asii). Jedním z jeho důsledků je vznik hemolytické anémie (pro narušení antioxidačních systémů erytrocytů). Blížší informace můžete najít v multimediálních skriptech Funkce buněk a lidského těla, 3. LF UK
Metabolismus fruktózy
Fruktózu můžeme přijímat v potravě buď volnou (ovoce, med), nebo v podobě disacharidu sacharózy.
Ta je v trávicím traktu rozkládána sacharázou na fruktózu a glukózu. Fruktóza se vstřebává do enterocytů facilitovanou difúzí skrze specifický přenašeč. Menší část fruktózy se již v enterocytech přemění na glukózu (přes Glc-6-P), většina je ale vypuštěna do portální krve.
Metabolickým osudem fruktózy je její zapojení se do glykolýzy, k čemuž slouží dvě cesty s rozdílnou orgánovou lokalizací.
Osud fruktózy v těle
Osud fruktózy v játrech
Fruktóza je jednak velmi rychle vychytávána játry, kde je také metabolizována pomocí enzymu fruktokinázy specifického pro fosforylaci fruktózy. Podívejme se nyní na příslušnou reakci:
- Fruktóza + ATP → fruktóza-1-P + ADP
- katalyzuje fruktokináza
Fruktóza-1-P není meziproduktem glykolýzy a jeho další přeměnu katalyzuje tzv. aldoláza B (odlišná od aldolázy A v glykolýze).
Štěpením Fruktózy-1-P vznikají dvě triózy – glyceraldehyd a dihydroxyacetonfosfát.
- Dihydroxyacetonfosfát se jako meziprodukt glykolýzy do ní může ihned zapojit.
- Glyceraldehyd má osud složitější. Může být fosforylován pomocí specifické kinázy na glyceraldehyd-3-fosfát, nebo může být redukován na glycerol.
- Fosforylace je mnohem významnější, neboť slouží k napojení glyceraldehydu na glykolýzu.
- Fruktóza-1-P → dihydroxyacetonfosfát + D-glyceraldehyd
- katalyzuje specifická aldoláza B
- Fruktóza-1-P → dihydroxyacetonfosfát + D-glyceraldehyd
- Dihydroxyacetonfosfát → glyceraldehyd-3-P → glykolýza
- D-glyceraldehyd → glyceraldehyd-3-P → glykolýza
- nebo → glycerol → glycerol-3-fosfát → triacylglyceroly
Metabolismus fruktózy je rychlejší než metabolismus glukózy, neboť se obchází hlavní regulační (nejpomalejší) krok glykolýzy katalyzovaný fosfofruktokinázou.
Výsledně to může vést ke zvýšené jaterní lipogenezi – z nadbytku vznikajícího pyruvátu (a následně AcCoA) vzniká nadměrné množství mastných kyselin a triacylglycerolů.
Alternativní osud fruktózy
V menší míře a také v jiných tkáních (např. ve svalech) je fruktóza fosforylována hexokinázou:
- Fruktóza + ATP → fruktóza-6-P + ADP
Vzniklý Fruktóza-6-P je přímo meziproduktem glykolýzy, a cesta napojení fruktózy proto trvá mnohem kratší dobu.
Hexokináza má ale pro fruktózu vyšší Km a tedy nízkou afinitu.
Význam fruktózy pro spermie
Spermie využívají fruktózu jako svůj hlavní energetický zdroj.
Proto nepřekvapí, že v seminální tekutině je velmi vysoká koncentrace fruktózy (5–10 mmol/l), kterou produkují seminální žlázky z glukózy.
Nejdříve dochází k redukci glukózy na sorbitol, ten se následně oxiduje na fruktózu.
Metabolismus galaktózy
Galaktóza, 4-epimer glukózy, je součástí mléčného cukru laktózy (disacharid). Tu v trávicím traktu štěpí enzym laktáza na galaktózu a glukózu. Tyto monosacharidy jsou následně vstřebány sekundárně aktivním transportem do enterocytů.
V játrech je galaktóza galaktokinázou fosforylována na galaktóza-1-P a následně přeměněna na glukózu:
- Galaktóza-1-P + UDP-glukóza → UDP-galaktóza + glukóza-1-P
- (katalyzuje hexóza-1-fosfáturidyltransferáza)
- UDP-galaktóza → UDP-glukóza
- (katalyzuje 4-epimeráza)
Galaktóza se při ní nemůže přeměnit na glukózu, a proto se hromadí v orgánech - játrech, erytrocytech, střevě, oční čočce, ledvinách, srdci či mozku.
Z galaktózy vzniká galaktitol (neboli dulcitol, cukerný alkohol vznikající redukcí galaktózy), který podmiňuje vznik zákalu oční čočky.
V léčbě se proto zcela zásadně ze stravy vylučují mléčné výrobky.
Přeměna glukózy na galaktózu
Galaktóza se v lidském těle využívá k syntéze laktózy v laktující mléčné žláze či při tvorbě glykoproteinů, proteoglykanů a glykolipidů.
Jak již bylo uvedeno výše, vzájemná přeměna glukózy na galaktózu (a zpět) neprobíhá ve formě volných sacharidů. Ty musí být nejdříve aktivovány.
Po aktivaci glukózy na UDP-1-glukózu dochází k její izomeraci na UDP-galaktózu:
- UDP-1-glukóza ↔ UDP-galaktóza
- (katalyzuje 4-epimeráza)
- Vytvořená UDP-galaktóza je makroergní sloučenina a může se přímo využít k syntéze výše zmíněných sloučenin.
Syntéza laktózy probíhá pouze v laktující mléčné žláze.
Slučují se při ní UDP-galaktóza s glukózou (katalyzuje galaktosyltransferáza).
Laktaci podporuje prolaktin – peptidový hormon z adenohypofýzy.
Přeměna glukózy na kyselinu glukuronovou a její využití
Kyselina glukuronová patří mezi tzv. uronové kyseliny, základní součásti mnoha pro tělo významných látek – např. glykosaminoglykanů, a tedy i proteoglykanů.
Uronové kyseliny se mimo to využívají i jako konjugační činidla usnadňující vylučování mnoha endogenních i cizorodých látek. Kromě kyseliny glukuronové řadíme mezi uronové kyseliny i kyselinu L-iduronovou či galaktouronovou.
Tvorba kyseliny glukuronové z glukózy spočívá v oxidaci primární hydroxylové skupiny na C6 molekuly glukózy na karboxylovou skupinu.
Před samotnou oxidací musí být ale molekula glukózy nejdříve převedena do aktivní formy – UDP-glukózy. Jednotlivé kroky přeměny glukózy na kyselinu glukuronovou probíhají tedy takto:
1) Fosforylace glukózy (katalyzuje hexokináza/glukokináza):
- Glukóza + ATP → glukóza-6-P + ADP
2) Izomerace glukózy (katalyzuje glukózafosfátisomeráza):
- Glukóza-6-P → glukóza-1-P
3) Aktivace glukózy – vazba UDP (katalyzuje UDP-glukózapyrofosforyláza):
- Glukóza-1-P + UTP → UDP-1-glukóza + difosfát
4) Oxidace na glukuronát:
- UDP-1-glukóza + 2 NAD+ → UDP-glukuronát + 2 NADH+H+
- UDP-glukuronát je aktivní formou kyseliny glukuronové a může vstoupit do mnoha reakcí.
Využití kyseliny glukuronové
Kyselina glukuronová je derivátem glukózy. Šestý uhlík glukozy je oxidován na karboxylovou skupinu a stává se tedy karboxylovou kyselinou. Je jednou ze tří karboxylových kyselin odvozených od glukozy, společně s kyselinou glukonovou a glukarovou.
Využití kyseliny glukuronové
1) Syntéza proteoglykanů
2) Využití jako konjugačního činidla
Kyselina glukuronová se konjuguje s látkami špatně rozpustnými ve vodě (bilirubin, steroidní hormony, xenobiotika) s cílem vyloučit je z organismu.
Po navázání kyseliny glukuronové se nepolární sloučeniny stávají rozpustnějšími ve vodě a lépe se vylučují močí nebo žlučí. Klíčový enzym se nazývá UDP - glukuronyltransferáza. Více informací se dozvíte v multimedálních skriptech 3. LF UK
Odkazy
Související články
Externí odkazy