Poruchy acidobazické rovnováhy
(přesměrováno z Poruchy ABR)
Jako poruchy acidobázické rovnováhy (ABR) označujeme stavy, kdy:
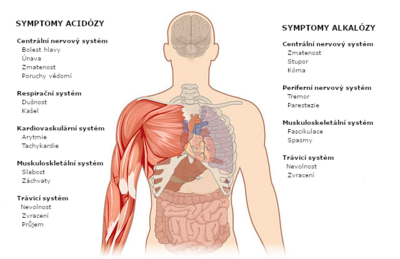
- pH vnitřního prostředí je odchýleno od normy (acidémie, alkalémie)
nebo
- v organismu je přebytek nebo nedostatek kyselin či bází, tj. dochází ke změně složení pufrů (které může a nemusí být doprovázeno změnou výsledného pH; acidóza, alkalóza).
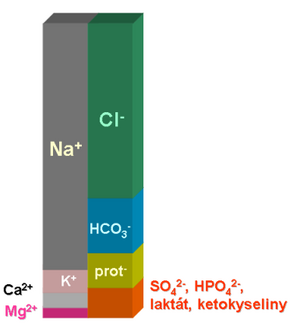
Pro rychlé udržování pH má největší význam hydrogenuhličitanový pufr. Jedna jeho složka, (HCO3-), má náboj a tvoří poměrně významnou položku v ionogramu. Acidobázická rovnováha je proto těsně spojena s metabolismem hlavních iontů. V praxi platí, že každá větší porucha acidobazické rovnováhy bude provázena také poruchou v mineralogramu. A naopak, výraznější změny v ionogramu bývají provázeny poruchou acidobazické rovnováhy. Více o vztazích mezi acidobázickou rovnováhou a ionogramem najdete zde.
Respirační poruchy acidobazické rovnováhy
Pokud se změní ventilace, mění se parciální tlak oxidu uhličitého v krvi, a tedy i koncentrace konjugované kyseliny hydrogenuhličitanového pufru. Konkrétně:
- hyperventilace provázená hypokapnií povede k respirační alkalóze
a naopak
- hyperkapnie způsobená ventilační poruchou bude mít za následek respirační acidózu.
Metabolické poruchy acidobazické rovnováhy
Jako metabolické poruchy ABR označujeme stavy, při nichž se významně mění koncentrace hydrogenuhličitanů (přesněji: standardních hydrogenuhličitanů – viz Vyšetření acidobazické rovnováhy). Současně se vždy změní i koncentrace jednoho či více hlavních iontů, neboť hydrogenuhličitanový anion musí být v rovnováze s ostatními ionty tělesných tekutin (více v kapitole Vztahy mezi acidobazickou rovnováhou a ionogramem).
Metabolická acidóza
Jako metabolickou acidózu označujeme stavy, kdy dojde k poklesu koncentrace standardních hydrogenuhličitanů pod referenční hodnoty. V principu se tak může stát:
- v důsledku hromadění některého aniontu, který hydrogenuhličitany z mineralogramu „vytlačí“;
- v důsledku ztrát hydrogenuhličitanů (doprovázených kationtem, nejspíše tedy jako hydrogenuhličitanu sodného);
- vzácněji: v důsledku ztrát některého kationtu, nejspíše sodíku, jež jsou kompenzovány poklesem koncentrace hydrogenuhličitanů.
Metabolická acidóza z hromadění aniontů
- Laktátová acidóza
- kyselina mléčná v prostředí, jehož pH je blízké hodnotě 7,4, prakticky zcela disociuje na laktátový anion. Koncentrace laktátu významně stoupá zejména při tkáňové hypoxii.
- Ketoacidóza
- (z hlediska ABR hromadění β-hydroxybutyrátu a acetacetátu). Rozvíjí se, pokud glukóza nepostačuje jako zdroj energie a ve zvýšené míře se odbourávají tuky: při hladovění, diabetu 1. typu, extrémní zátěži apod.
- Renální acidóza
- při selhání ledvin se hromadí sulfáty, fosfáty a další anionty, které by se normálně vyloučily do moči.
- Acidóza při některých otravách
-
- intoxikace etanolem – etanol se metabolizuje na acetát.
- Kromě nadprodukce acetátu hraje významnou úlohu produkce NADH při odbourávání etanolu. Vysoká koncentrace redukčních ekvivalentů inhibuje odbourávání laktátu, který se hromadí. Podobně NADH inhibuje glykolýzu, což v konečném důsledku vede ke stimulaci ketogeneze a hromadění β-hydroxybutyrátu a acetacetátu.
- intoxikace metanolem – metanol se metabolizuje na formiát;
- intoxikace etylenglykolem – metabolizuje se na oxalát.
Metabolická acidóza ze ztrát hydrogenuhličitanů
Je nejčastěji důsledkem ztrát hydrogenuhličitanů z gastrointestinálního traktu. Duodenální a pankreatická šťáva jsou bohaté na hydrogenuhličitany, které mají neutralizovat tráveninu přicházející ze žaludku. Normálně se hydrogenuhličitany resorbují zpět v tenkém střevě. Při některých onemocněních GIT (průjmy, syndrom krátkého střeva…) může být resorpce natolik nízká, že koncentrace hydrogenuhličitanů v krvi významně klesne.
Jinou příčinou mohou být ztráty hydrogenuhličitanů ledvinami (renální tubulární acidóza, nežádoucí účinek diuretické léčby apod.). Do skupiny metabolických acidóz ze ztrát hydrogenuhličitanů můžeme také zařadit tzv. diluční acidózu. Dochází k ní při rychlém podání infuzí. Hydrogenuhličitany se v krvi naředí rychleji, než se stačí metabolismem doplňovat. Pochody, které udržují parciální tlak oxidu uhličitého, jsou mnohem rychlejší, takže pCO2 se nemění.
Selhání ledvin
Při selhání ledvin se typicky rozvíjí metabolická acidóza. Schází se několik poruch, které na acidobázickou rovnováhu působí stejným směrem:
- hromadění síranů,
- hromadění fosfátů,
- hyperurikémie – kyselina močová se za pH blízkého fyziologickému chová jako anion,
- při zachování diurézy a tubulárním poškození selhává reabsorpce hydrogenuhličitanů.
Metabolická alkalóza
Metabolická alkalóza je charakterizována vzestupem koncentrace standardních hydrogenuhličitanů. V zásadě může být důsledkem:
- ztrát některého aniontu, obvykle chloridů nebo proteinů, které jsou v ionogramu kompenzovány doplněním hydrogenuhličitanů;
- vzestupu koncentrace některého kationtu, nejčastěji sodíku.
Alkalóza ze ztrát aniontů
- Hypochloremická alkalóza
- Doprovází například protrahované zvracení, při němž se ztrácí velké množství chloridového aniontu vyzvrácenou žaludeční šťávou. Jinou příčinou hypochloremické alkalózy může být podávání diuretik.
- Hypoproteinémie
- Bílkoviny se chovají jako polyanionty, takže pokles jejich koncentrace se také kompenzuje doplněním hydrogenuhličitanů. Typickými příklady může být selhání proteosyntézy v játrech, ztráty bílkovin při nefrotickém syndromu, či malnutrice.
Hypernatremická alkalóza
Je nejčastěji důsledkem hyperaldosteronismu. K primárnímu hyperaldosteronismu vedou např. některé nádory nadledvin, případně jiné tumory produkující tento hormon. Častější je sekundární hyperaldosteronismus jako následek jaterního selhání, neboť aldosteron se v játrech odbourává. Jinou příčinou sekundárního hyperaldosteronismu může být nadměrná aktivace systému renin-angiotensin-aldosteron.
Zvýšená hladina aldosteronu způsobí, že ledviny retinují více sodíku, což se v ionogramu kompenzuje doplněním hydrogenuhličitanového aniontu. Šetření sodíku navíc probíhá na úkor zvýšených ztrát draslíku a protonů do moči, což vede k dalšímu prohlubování alkalózy.
Retenci sodíku způsobují i kortikosteroidy, metabolická alkalóza proto provází i Cushingův syndrom.
Alkalóza z nadbytku jiných kationtů
Vzácněji může být metabolická alkalóza způsobena nadbytkem jiného kationtu, např. ionizovaného vápníku. Dochází k ní např. při nádorech kostí (mnohočetný myelom, metastázy karcinomu prsu, prostaty apod.). Při odbourávání kostní tkáně se uvolňuje velké množství Ca2+, ale i HCO3-.
Selhání jater
Selhání jater typicky bývá provázeno metabolickou alkalózou. Její příčinou jsou:
- hypoproteinémie při selhání proteosyntézy;
- sekundární hyperaldosteronismus s retencí sodíku – aldosteron se normálně odbourává játry;
- zpomalení ureasyntetického cyklu – metabolického děje, který produkuje proton na každou molekulu vzniklé močoviny.
Kombinované poruchy acidobazické rovnováhy
V praxi se lze často setkat s kombinací několika poruch acidobázické rovnováhy. Významná je zejména kombinace metabolické acidózy s metabolickou alkalózou: při vyšetření ABR dle Astrupa mohou být jednotlivé parametry v normě nebo jen mírně vychýlené. Kombinovaná porucha ABR proto nemusí být rozpoznána, nebo může být podhodnocena. Přitom léčebný zásah, který ovlivní jednu z dílčích poruch, může způsobit, že druhá porucha rychle převáží. Tím může dojít k prudké změně pH vnitřního prostředí a těžkému metabolickému rozvratu.
Stavy vedoucí ke kombinovaným poruchám ABR nejsou vzácné. Typickými příklady mohou být:
- zvracení a průjem
- zvracení vede k hypochloremické alkalóze, průjem k acidóze ze ztrát hydrogenuhličitanů
- protrahované zvracení
- hypochloremická alkalóza při zvracení se kombinuje s ketoacidózou způsobenou hladověním a laktátovou acidózou z nedostatečné perfuze tkání při hypovolémii
- hepatorenální selhání
- kombinuje se jaterní metabolická alkalóza s renální acidózou
- selhání jater s respirační insuficiencí
- těžká hypoproteinémie při selhání jater vede k plicnímu edému, v důsledku hypoxie se rozvíjí laktátová acidóza
- selhání ledvin s nefrotickým syndromem a těžkou hypoproteinémií
- renální acidóza z hromadění sulfátů a fosfátů je provázena alkalózou při hypoproteinémii
Korekce a kompenzace poruch acidobázické rovnováhy
Dojde-li z jakéhokoliv důvodu k poruše ABR, začne organismus vyvíjet úsilí, aby udržel pH vnitřního prostředí. V podstatě vůči původní poruše ABR bojuje další poruchou, která vychyluje pH opačným směrem. Rozlišujeme dvě skupiny takových mechanismů:
- Kompenzace znamená, že při metabolické poruše se pH vnitřního prostředí udrží změnou respirace. Například metabolická acidóza se kompenzuje respirační alkalózou; pacient bude usilovně hluboce dýchat („Kussmaulovo dýchání“).
- O korekci mluvíme jen v případě metabolických poruch ABR: jedna metabolická odchylka se koriguje druhou. Např. pacient s jaterním selháním (a tedy s metabolickou alkalózou) bude ledvinami vylučovat více hydrogenuhličitanů a bude méně acidifikovat moč.
Rozvinutí korekčních a kompenzačních mechanismů vyžaduje určitý čas. Ke změně respirace dochází téměř okamžitě po vzniku poruchy ABR. Respirační kompenzační mechanismy se poté prohlubují, maxima dosáhnou asi za 12 – 24 hodin. Kompenzace a korekce na úrovni ledvin jsou mnohem pomalejší – musí se totiž přeregulovat některé transportní mechanismy, což často vyžaduje syntézu proteinů. Svého maxima dosahují tyto mechanismy až za pět dní.
Při příchodu do velkých nadmořských výšek je třeba počítat s asi pětidenní aklimatizací. Příčinou vysokohorské nemoci je totiž hyperventilace, kterou se organismus snaží čelit hypoxii. Usilovné dýchání ovšem příliš nezlepší saturaci hemoglobinu kyslíkem – na to je příliš nízký parciální tlak O2 v okolní atmosféře, ale vede k respirační alkalóze. Právě alkalóza a iontová nerovnováha je příčinou projevů vysokohorské nemoci, včetně otoku mozku, otoku plic a tachykardie. Aklimatizace spočívá v přeregulování ledvin – v podstatě ve vzniku metabolické acidózy, což trvá zmíněných 5 dní. Lze ji urychlit příjmem velkého množství tekutin, neboť se zvýší ztráty hydrogenuhličitanů do moči. Jako součást léčby vysokohorské nemoci se někdy doporučuje podávání acetazolamidu – inhibitoru karboanhydrázy, který sníží acidifikaci moči (novější práce však považují podávání acetazolamidu za málo účinné).
Principy léčby poruch acidobázické rovnováhy
Léčba metabolické acidózy
Základem léčby těžší metabolické acidózy bývá podávání hydrogenuhličitanu sodného, ať už parenterálně v rámci komplexní infuzní terapie, nebo perorálně. Výhodou enterálního podání je, že je organismu ponechána regulace vstřebávání hydrogenuhličitanů, takže se není třeba tolik obávat přílišné alkalizace. Na druhou stranu je tato cesta pomalejší a méně účinná, navíc u pacientů v těžším stavu může být porušena resorpce.
Lehčí a chronická metabolická acidóza se často upravuje podáváním organických kyselin a jejich solí. Hydrogenuhličitany vznikají vlastně až jejich metabolizováním v citrátovém cyklu. Podmínkou je dobrá funkce jater. Nejčastěji se používá laktát (např. Ringerův infuzní roztok s laktátem) a citrát (např. v roztocích pro perorální rehydrataci používaných k léčbě průjmových onemocnění).
Pokud acidóza a acidémie trvala delší dobu, je nutné pH vnitřního prostředí upravovat pomalu.
Je třeba mít na paměti, že dechové centrum reaguje na pCO2 jako acidobázický senzor: CO2 difunduje z krve do prostředí bohatého na HCO3-, takže vzniká pufr. Jeho pH záleží na aktuálním pCO2. Nervová zakončení reagují na kyselost prostředí. Při acidóze trvající několik dní dojde k přeregulování respiračního centra. Prudká alkalizace vnitřního prostředí by mohla vést k tomu, že by se respirační centrum chovalo jako při hypokapnii – tedy hyperventilaci: došlo by k útlumu dýchání, až k respirační insuficienci.
Léčba metabolické alkalózy
Léčba metabolické alkalózy bývá nejčastěji založena na podávání fyziologického roztoku. Zatímco v krvi je koncentrace sodných kationtů vyšší než koncentrace chloridových aniontů, ve fyziologickém roztoku jsou oba ionty v poměru 1:1. Podáváním fyziologického roztoku tedy do organismu dodáváme nadbytek chloridů. Tím dochází v ionogramu k vytlačení hydrogenuhličitanů a alkalóza se koriguje.
Odkazy
Související články
- Vztahy mezi acidobazickou rovnováhou a ionogramem
- Laboratorní vyšetření acidobazické rovnováhy
- Acidobazická rovnováha