Skleněná elektroda
Nejstarší a dosud nejrozšířenější iontově selektivní elektrodou, která se používá k měření pH, je elektroda skleněná. Zpravidla se konstruuje v jednom těle přímo s vhodnou referentní elektrodou. Existuje řada modifikací; zde si ukážeme princip na základním provedení.
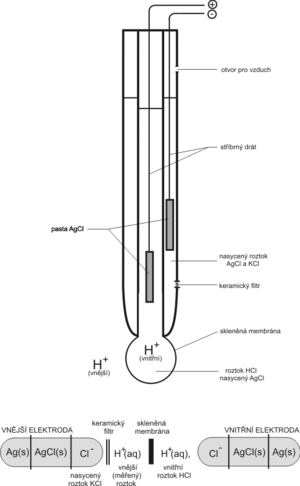
Schopnost skleněné elektrody indikovat koncentraci H+ si můžeme zjednodušeně vysvětlit tím, že skleněná membrána (banička s velmi tenkými stěnami vyfouknutá ze speciálního skla) je propustná pro H+ a nepropustná pro jiné ionty. Ve vnitřním elektrolytu je ponořený stříbrný drátek potažený vrstvou AgCl. Podle kyselosti měřeného roztoku se mění koncentrace H+ uvnitř baničky. Ionty Cl− membránou neprocházejí, a tak aby byla zachována elektroneutralita roztoku, dochází k reakci na elektrodě
- AgCl + e− Ag+ + Cl−.
Ponoříme-li elektrodu do kyselého roztoku, způsobí nadbytek H+ iontů, že se z pasty AgCl bude uvolňovat více iontů Cl−. Tím se spotřebuje více elektronů ze stříbrného drátku a elektroda získá vůči referentní kladnější napětí. Naopak v zásaditém prostředí bude nadbytek Cl− odevzdávat své elektrony a na elektrodě bude zápornější napětí.
Jako referentní elektroda se v pH-metrii nejčastěji používá opět stříbrný drát potažený pastou AgCl, tentokrát je však ponořený v roztoku KCl s přesnou koncentrací (tj. v roztoku s konstantní koncentrací Cl−, např. nasycený, 1 mol·l−1, 3 mol·l−1 apod.). Potenciál referentní elektrody není ovlivněn koncentrací H+ iontů. Elektrolyt referentní elektrody bývá s měřeným roztokem vodivě propojen pomocí můstku s keramickou přepážkou (fritou).
Uvedený popis pH-metrické elektrody je značně zjednodušený. Skutečné pochody na skleněné membráně jsou popsány na podstránce podrobnosti o skleněné elektrodě.