Stanovení enzymové aktivity
Enzymy jsou v biologickém materiálu obsaženy ve velmi nízkých koncentracích. Pro popis biochemických dějů je navíc užitečnější znát jejich účinnost spíše než samotné množství enzymu. Namísto měření koncentrace enzymu se proto většinou s výhodou využívá substrátové specifičnosti enzymů a jejich značné katalytické účinnosti při měření aktivity enzymu. Množství enzymu tedy kvantifikujeme nepřímo na základě rychlosti, jakou enzym katalyzuje přeměnu substrátu na produkt ve zvoleném časovém intervalu. Tato metoda je dostatečně specifická za předpokladu, že na substrát působí v daném materiálu jen jeden enzym. Je i dostatečně citlivá a přesná, je-li zvolena vhodná koncentrace substrátu vzhledem k enzymu a vhodná metoda stanovení úbytku substrátu nebo přírůstku produktu v čase, neboli vhodná metoda stanovení rychlosti přeměny substrátu na produkt.
Enzymová aktivita[upravit | editovat zdroj]
Abychom mohli snadno porovnávat rychlost úbytku substrátu nebo přírůstku produktu v různých časových intervalech, je účelné, aby tyto rychlosti byly v čase konstantní, tj. aby reakce probíhala podle kinetiky nultého řádu. Toho lze dosáhnout, přísně vzato, jen tehdy, je-li veškerý enzym substrátem nasycen, tj. když je veškerý enzym o celkové koncentraci [E]t vázán v formě enzym-substrátovém komplexu ES. Taková situace nastává jen při velkém nadbytku substrátu. Pak probíhá enzymová reakce s maximální rychlostí Vmax. Za této situace můžeme snadno definovat i jednotky enzymové aktivity, protože zdvojnásobíme-li koncentraci enzymu, vzroste dvojnásobně i maximální rychlost Vmax apod.
Za podmínky, že enzym pracuje v prostředí se značným nadbytkem substrátu, můžeme tedy kineticky vyjádřit množství enzymu [E]t jako rychlost Vmax. Jako jednotka množství enzymu, správněji množství enzymové aktivity, slouží katal (1 kat). Je to takové množství enzymové aktivity, které katalyzuje přeměnu 1 molu substrátu za sekundu. Pro praxi je tato jednotka hodně velká, proto většinou pracujeme s jejími zlomky – mikrokataly (1 μkat = 10−6 kat), nanokataly (1 nkat = 10−9 kat) a pikokataly (1 pkat = 10−12 kat)
Převod enzymových jednotek (U) na kataly (kat) se řídí vztahem:
- 1 U = 1 μmol/min = 1/60 μmol/s = 1/60 μkat = 16,67 nkat .
V předchozím textu jsme předpokládali, že rychlost enzymové reakce sledujeme při maximálním nasycení enzymu substrátem (kinetika nultého řádu), tedy při dosažení maximální rychlosti Vmax. Za těchto podmínek je Vmax úměrná koncentraci enzymu. Kinetiky nultého řádu lze však aproximativně využít i tehdy, jestliže enzym substrátem nasycen není, tj. i při menších koncentracích substrátu. Je to však možné jen tehdy, pokud se v průběhu měření koncentrace substrátu [S] příliš nemění – tj. příliš se nesnižuje oproti počáteční koncentraci substrátu [S]0. Tato podmínka je naplněna, sledujeme-li průběh reakce jen v prvních minutách, kdy je úbytek koncentrace substrátu menší než zhruba jedna desetina původní hodnoty. Rychlost reakce v této fázi označujeme jako počáteční rychlost v0. Rovněž koncentraci enzym-substrátového komplexu [ES] můžeme v této fázi pokládat za stálou (steady-state). Při větším úbytku substrátu (poklesu koncentrace [S]) ovšem koncentrace [ES] klesá, takže kinetika nultého řádu přechází do kinetiky prvého, druhého i vyššího řádu.
Michaelisova konstanta[upravit | editovat zdroj]
Pomocí iniciální rychlosti v0 lze sledovat pro určité předpokládané množství enzymové aktivity vztah této rychlosti v0 k určité výchozí koncentraci substrátu [S]0. Můžeme se tedy zabývat chováním enzymové reakce v situacích, kdy není dosaženo maximální rychlosti Vmax pro celkovou koncentraci enzymu [E]t. U téhož enzymu může být ovšem pojem vysoké a nízké koncentrace substrátu relativní – může totiž záviset na konkrétním typu substrátu a na tom, jakou má enzym k tomuto substrátu afinitu. Využíváme proto veličinu, která je pro danou dvojici enzym-substrát charakteristickou konstantou. Je to tzv. Michaelisova konstanta (Km), která označuje takovou látkovou koncentraci substrátu, při níž je rychlost enzymové reakce (v) polovinou rychlosti maximální (Vmax).
Michaelis a Mentenová odvodili vztah mezi Km, [S], v a Vmax:
Nízká hodnota Km značí velkou afinitu enzymu k substrátu. Vedle toho, že Km charakterizuje danou dvojici enzym-substrát, je sledování Km nezbytné též k odlišení mechanismu inhibice (nejčastěji typu kompetitivního nebo nekompetitivního).
Stanovení Michaelisovy konstanty[upravit | editovat zdroj]
Počáteční rychlost enzymové reakce se snáze měří pro nízké počáteční koncentrace substrátu [S]0; při vysokých koncentracích substrátu je reakční rychlost vysoká, substrát se rychle spotřebovává a reakční rychlost se tak podstatně mění během krátké doby od zahájení reakce. Ovšem vyneseme-li do grafu reakční rychlosti v proti počátečním koncentracím substrátu [S]0, je obtížné přímo z tohoto grafu určit parametry Vmax a Km, máme-li k dispozici jen měření při nízkých koncentracích substrátu. Vzniklo proto několik postupů, jak tyto parametry určit.
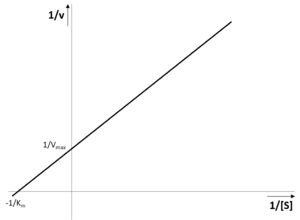
Mezi nejčastěji zmiňované grafické metody patří transformace dat podle Lineweavera a Burka. Hyperbolickou závislost rychlosti v na koncentraci substrátu [S]
můžeme snadno transformovat na lineární funkci – převrácená hodnota rychlosti 1/v totiž lineárně závisí na převrácené hodnotě koncentrace substrátu 1/[S]:
Vynášíme-li 1/v na na svislou osu a 1/[S] na vodorovnou osu, budou za podmínek kinetiky 2. řádu naměřená data ležet v přímce. Tato přímka protíná svislou osu v hodnotě 1/Vmax a vodorovnou osu v hodnotě −1/Km.
Metoda podle Lineweavera a Burka je bohužel citlivá i na relativně malé chyby měření při nízkých koncentracích substrátu. Přesnější grafickou metodou pro stanovení parametrů Vmax a Km je metoda podle Eisenthala a Cornishe-Bowdena. Postupuje se při ní takto:
- Pro několik koncentrací substrátu [S] naměříme experimentálně reakční rychlosti v. Tyto hodnoty vyneseme do grafu jako závislost v na [S].
- Pro každý vynesený bod vyznačíme hodnotu [S] na vodorovné ose (bod A) a hodnotu v na svislé ose (bod B). Sestrojíme přímku, která prochází body A a B.
- Z polohy průsečíku takto sestrojených přímek lze odečíst hodnoty Km a Vmax (průsečík má souřadnice [−Km, Vmax]).
Jinou grafickou metodou je vynesení podle Eadie-Hofsteeho. Vynáší se v na svislé ose proti v/[S] na vodorovné ose a body se proloží přímkou. Vmax se vyhledá jako průsečík této přímky se svislou osou, Vmax/Km je průsečík s vodorovnou osou a směrnice přímky je −Km.
Grafické metody jsou sice ilustrativní, v současnosti se ovšem kinetické parametry počítají metodami nelineární regrese.

![{\displaystyle v={\frac {V_{max}\cdot [S]}{K_{m}+[S]}}={\frac {V_{max}}{1+{\frac {K_{m}}{[S]}}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/9424b4e5f247badad335f81a11af50d7897741c2)
![{\displaystyle v={\frac {V_{max}\cdot [S]}{K_{m}+[S]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/8eda6aa5aa3359bda1809e8612cbc3069bc1320b)
![{\displaystyle {1 \over v}={\frac {K_{m}+[S]}{V_{max}\cdot [S]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/b40da210920ab7e4c220175e5110c188b4c84151)
![{\displaystyle {1 \over v}={K_{m} \over V_{max}}\cdot {1 \over [S]}+{1 \over V_{max}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/904a5028d9114b19392bb710c040ce286b6dfe61)
