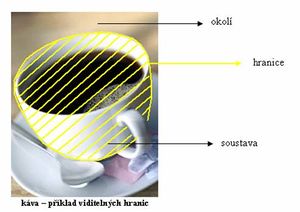
Termodynamický systém
Termodynamický systém je množina prvků oddělených od ostatních objektů (prvků), kterým se souhrnně říká okolí, myšleným či skutečným rozhraním. Okolí je tedy vše, co není systém.
Jde o systém fyzikální, a proto zákony vzájemné přeměny tepelné a jiných forem energie sledujeme pomocí makroskopického přístupu, což značně zjednodušuje popis tepelných dějů v systému.
Termodynamika je součástí termiky a zkoumá zákony vzájemné přeměny tepelné energie a jiných energií. Tyto přeměny sledujeme právě v termodynamickém systému. Pro termodynamický systém platí termodynamické věty. První zákon je zákonem zachování energie, druhý omezuje platnost prvního zákona, že totiž energie je zachována, ale s určitou ztrátou. Třetí zákon pojednává o stavové veličině, entropii. To je obecná tendence ke stále větší neuspořádanosti všeho ve vesmíru.
Také lidský organizmus můžeme vnímat jako termodynamický systém (otevřený), který se ovšem vyznačuje tím, že svými projevy neustále narušuje termodynamickou rovnováhu. Zdánlivě porušuje třetí termodynamický zákon snižováním entropie. Více viz článek Termodynamika a živé organismy.
Termodynamický systém popisujeme stavovými veličinami. To je například teplota, tlak, objem, koncentrace, látkové množství. Tyto veličiny vyjadřují okamžitý stav systému. Nezávisí na tom, jakými fyzikálními pochody se systém do tohoto stavu dostal. Teplota není v termodynamickém systému nikdy určována přímo. Vždy sledujeme jinou veličinu, která je teplotou dokazatelně ovlivňována. Můžeme ji také porovnat s teplotou, která je typická pro určité stavy systému. Tím je např. teplota varu vody.
Podle výměny látek a energie s okolím dělíme systémy na:
- izolované
- uzavřené
- otevřené
Izolovaný systém[upravit | editovat zdroj]
Tento systém si se svým okolím nevyměňuje nic. Ani hmotu ani energii. Po určitém čase dosáhne rovnovážného stavu, v němž se makroskopicky nemění. Dosažením rovnovážného stavu nabývá veličina entropie maximálních hodnot a dále je její změna nulová. Příkladem izolovaného systému může být termoska, která v ideálním případě udržuje jak teplo, tak i chlad.
Uzavřený systém[upravit | editovat zdroj]
Systém si s okolím vyměňuje energii, nikoli však částice. Například hrneček s teplým čajem přikrytý pokličkou. Čaj po čase stydne, ale neubývá. Další možný příklad je ohřívací sáček, který po prohnutí kovového plíšku začne uvolňovat teplo. Toho se využívá při lokálním léčení bolestivých míst, např. natažených svalů.
Otevřený systém[upravit | editovat zdroj]
Dochází zde k výměně částic i energie s okolím. Každý živý organismus (tedy i lidský) je otevřeným systémem, protože ke svému životu potřebuje látky a energii z okolí přijímat a stejně tak i okolí předávat. Vytváří tedy nedílnou součást okolního světa. Další příklad může být již výše zmíněný hrneček, tentokrát bez pokličky, kdy spolu s energií v podobě par unikají molekuly vody. Tímto způsobem se léčí zánět dutin nahříváním v domácím prostředí, kdy se pacient pro větší efekt zakryje ručníkem a inhaluje.
Kvůli své neustálé interakci s okolím se otevřené a uzavřené systémy obvykle nacházejí v nerovnovážných stavech.
Termodynamické proměnné[upravit | editovat zdroj]
Termodynamický systém popisujeme pomocí termodynamických proměnných (parametrů). Proměnné jsou stavové vlastnosti. Dělíme je na intenzivní proměnné, které nesouvisí s velikostí systému a extenzivní proměnné, které závisejí na velikosti termodynamického systému
Intenzivní proměnné:
- hustota
- tlak
- teplo
Extenzivní proměnné:
- hmotnost
- objem
- energie
Odkazy[upravit | editovat zdroj]
Související články[upravit | editovat zdroj]
Použitá literatura[upravit | editovat zdroj]
- NAVRÁTIL, Leoš a Jozef ROSINA, et al. Medicínská biofyzika. 1. vydání. Praha : Grada, 2005. 524 s. s. 435-436. ISBN 80-247-1152-4.
Zdroje[upravit | editovat zdroj]
- BOJKOVSKÝ, Martin. Termodynamika [online]. [cit. 2013-09-12]. <http://fikus.omska.cz/~bojkovsm/termodynamika/zakladni_pojmy.html>.
- PROKŠOVÁ, Jitka a Jan DURŠPEK. Nerovnovážná termodynamika a její aplikace [online]. [cit. 2013-09-12]. <https://www.nelterm.kof.zcu.cz/nerterm/ntuvod/uvod.htm>.
Další doporučená literatura[upravit | editovat zdroj]
- OPATRNÝ, Tomáš. Kapitoly z termodynamiky a statistické fyziky [online]. [cit. 2014-01-25]. <http://www.ktf.upol.cz/tom/bookex1.pdf>.
- PROKŠOVÁ, Jitka a Jan DURŠPEK. Nerovnovážná termodynamika a její aplikace [online]. [cit. 2014-01-25]. <https://www.nelterm.kof.zcu.cz/index.htm>.