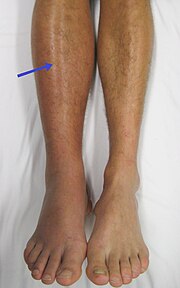
Vrozené trombofilie
Trombofilie (hyperkoagulační stav) je stav, který se vyznačuje především náchylností ke zvýšené tvorbě trombů. Může pak dojít ke vzniku trombózy, což je intravitální tvorba krevní sraženiny (trombu) v srdci nebo v cévách, anebo k tromboembolii, kdy se zanese trombus krevním proudem do vzdáleného místa. V tomto místě se sraženina zachytí a má funkční důsledky pro správný průtok krve. Dalším projevem trombofilie je zvýšený počet trombocytů.
Závažnost trombofilie se určuje na základě určité mutace (některé jsou více agresivní) a podle toho, zda je pacient nemocný v homozygotní nebo heterozygotní konstituci alel.
Klinickým projevem vrozené trombofilie jsou opakované žilní trombózy, nejčastěji v dolních končetinách (hlavně v lýtkách) a tromboembolie do plic. Tyto projevy se čím dál častěji vyskytují u mladých lidí, a to kvůli užívání hormonální antikoncepce u žen, kouření a sedavému způsobu života. Výjimku v poslední době netvoří ani proniknutí trombu do mozku vedoucí k mozkové cévní příhodě, a to se všemi jejími následky.
Etiologie[upravit | editovat zdroj]
Vrozená trombofilie má hned několik příčin:
- vrozený nedostatek nebo snížená funkce antitrombinu III,
- nedostatek proteinů C a S,
- nedostatek fibrinogenu,
- rezistence faktoru V (tzv. Leidenská mutace),
- poruchy fibrinolýzy (nedostatek plazminogenu, tPA, nadbytek PAI-1),
- nedostatek faktoru VIII (tzv. Von Willebrandova choroba).
Rezistence faktoru V[upravit | editovat zdroj]
Je vůbec nejčastější příčnou vzniku hyperkoagulačních stavů. Při mutaci faktoru V dochází k rezistenci proteolytického štěpení aktivovaným proteinem C. Většinou dojde k záměně aminokyseliny argininu za glutamin v molekule. Tato mutace se označuje jako leidenská mutace. Mezi heterozygoty patří asi 3 % populace a riziko tromboembolické nemoci je asi 7× vyšší, než je tomu u zdravé populace. Pokud se jedná o homozygotní konstituci, tak riziko vzniku tromboembolické nemoci stoupá až 20×. Při užívání HA, kouření a sedavém způsobu života stoupá riziko mnohonásobně vícekrát (i 100×).
Vrozený nedostatek nebo snížená funkce antitrombinu III[upravit | editovat zdroj]
Za rizikový faktor se pokládá snížení hladiny antitrombinu III pod 50 %, což platí i pro heterozygoty, kteří mají defektní jednu alelu. Některé mutace se vyznačují tím, že sníží účinnost tohoto f. při inhibici f. Xa a IIa. Tyto faktory snižují vazbu mezi antitrombinem III a heparinem, jeho aktivaci heparinem nebo jeho serinovou proteázovou aktivitu. Homozygoti to mají těžší v tom, že se předpokládá, že heparin nebude účinný pro snížení krevní srážlivosti. Pro to, aby heparin dobře reagoval, je nutný právě antitrombin III.
Nedostatek proteinů C a S[upravit | editovat zdroj]
Nedostatek těchto proteinů způsobuje autosomálně dominantní (AD) charakter onemocnění, a proto se nemoc projevuje, už když je postižena pouze jedna alela.
Fenotypově se tento nedostatek téměř vždy projevuje jako opakující se venózní trombóza nebo tromboembolie do plic. K léčbě se používají spíše léky na bázi heparinu než na bázi warfarinu kvůli tomu, že ![]() warfarin ještě snižuje účinek vitaminu K, což by mohlo vést k dalšímu snížení těchto proteinů a podpoření vzniku tromboembolické nemoci.
warfarin ještě snižuje účinek vitaminu K, což by mohlo vést k dalšímu snížení těchto proteinů a podpoření vzniku tromboembolické nemoci.
Nedostatek fibrinogenu (dysfibrinogenémie)[upravit | editovat zdroj]
Pokud dojde k mutaci v některých řetězcích, které tvoří molekulu fibrinogenu, je pravděpodobné, že jeho záměna na fibrin faktorem IIa (trombinem) bude snížená a dojde k celkové poruše srážení krve.
Poruchy fibrinolýzy[upravit | editovat zdroj]
Fibrinolýza je děj, během kterého dochází k přeměně pevného trombu do tekutého stavu, dojde tedy k jeho rozpuštění. Fibrinolýza je výsledek štěpení fibrinu proteolytickým enzymem plazminem. Plazmin vzniká ve sraženině z plazminogenu. Aby se plazminogen mohl přeměnit na účinný plazmin, musí být přítomen tkáňový plazminogenový aktivátor (tPA) a aktivátor urokinázového typu (uPA). V případě trombofilie se tedy jedná o nedostatečnou tvorbu nebo uvolnění tPA a rezistenci plazminogenu vůči aktivaci přes tPA a uPA.
Dispenzarizace[upravit | editovat zdroj]
Celkově platí, že sedavý způsob života podporuje kardiovaskulární onemocnění, a tedy vznik tromboembolické nemoci. Pacienti, u nichž je podezření na vrozenou trombofilii, si zajdou nejčastěji na hematologii na odběry, kde jim nechají udělat genetické testy hrazené pojišťovnou. V těchto testech se zjišťují nejčastější mutace, mezi které patří mutace f. V Leiden, mutace MTHFR a mutace f.VIII. Při zjištění některé této mutace se dále bere zřetel na to, zda je pacient homozygot nebo heterozygot v dané mutaci.
Pokud je např. heterozygot v mutaci MTHFR (metyltetrahydrofolát), můžeme s celkem velkou jistotou říci, že má malou pravděpodobnost vzniku tromboembolické nemoci. Pokud bude u pacienta mutantní f. V Leiden, a to ještě v homozygotní konstituci, je pravděpodobnost tromboembolické nemoci vysoká.
Při zjištění vrozené trombofilie pacient dostane kartičku s nápisem "POZOR! RIZIKO TROMBÓZY". V této kartičce je dále uvedeno místo, kde byla kartička vydána, základní údaje o pacientovi a název mutace. Dále jsou tam uvedeny kontraindikace. Pacient tuto kartičku nosí vždy při sobě v peněžence.
V případě imobilizace (fixace končetin, upoutání na lůžko, operace, dlouhé cesty dopravními prostředky, zaoceánské lety apod.) si pacient aplikuje preventivní antikoagulační léčbu nízkomolekulárním heparinem. Nejčastěji se předepisuje Clexane![]() nebo Zibor
nebo Zibor![]() . Tato antikoagulační léčba se doporučuje i v případě dehydratace, ve 3. trimestru gravidity, šestinedělí nebo při hormonální léčbě.
Tato antikoagulancia jsou ve formě injekcí, které se píchají nejčastěji do břicha (do tukové vrstvy).
Omezení platí také pro některou potravu, pacienti by neměli jíst špenát, kapustu a ostatní potraviny bohaté na vitamin K.
. Tato antikoagulační léčba se doporučuje i v případě dehydratace, ve 3. trimestru gravidity, šestinedělí nebo při hormonální léčbě.
Tato antikoagulancia jsou ve formě injekcí, které se píchají nejčastěji do břicha (do tukové vrstvy).
Omezení platí také pro některou potravu, pacienti by neměli jíst špenát, kapustu a ostatní potraviny bohaté na vitamin K.
Odkazy[upravit | editovat zdroj]
Související články[upravit | editovat zdroj]
- Plicní embolie
- Heparin
- Leidenská mutace
- Trombembolická nemoc v gynekologii
- Tromboembolická nemoc (pediatrie)
- Destičková zátka
Externí odkazy[upravit | editovat zdroj]
Zdroj[upravit | editovat zdroj]
- POVÝŠIL, Ctibor a Ivo ŠTEINER, et al. Obecná patologie. 1. vydání. Praha : Galén, 2011. 290 s. ISBN 978-80-7262-773-8.
- NEČAS, Emanuel. Patologická fyziologie orgánových systémů : Část I. 2. vydání. V Praze : Karolinum, 2009. 379 s. ISBN 978-80-246-1711-4.