Základní složky nukleových kyselin
Mononukleotid obsahuje tři složky, a sice pentózu, fosfát a dusíkatou bázi. Centrální postavení mezi nimi má pentóza, buď β-D-ribofuranóza (ribóza) nebo 2’-deoxy-β-D-ribofuranóza (deoxyribóza). V nukleotidech se uhlíky pentózy číslují s apostrofem (C2’..cé dvě s čarou), aby se odlišily od uhlíků báze. Podle typu pentózy se rozlišují ribonukleové kyseliny (ribonucleic acid, RNA) a deoxyribonukleové kyseliny (DNA). Pentóza se vyskytuje v různých konformacích. Jestliže C2’ vystupuje nad rovinu furanózového kruhu shodně s C5’, jde o konformaci 2’-endo, jestliže takto vystupuje C3’, konformace se nazývá 3’-endo. Konformace pentóz se mění při funkčně významných proměnách ve vyšší struktuře nukleových kyselin.
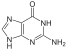
Na C1 pentózy je N-β-glykosidovou vazbou navázána báze. Báze jsou odvozeny buď od pyrimidinu (cytosin, uracil, thymin) nebo od purinu (adenin, guanin). V RNA se thymin vyskytuje jen výjimečně, DNA neobsahuje uracil. Nositelem bazického charakteru těchto sloučenin jsou heterocyklické dusíky, které však v buňce při pH kolem 7 nejsou protonovány.
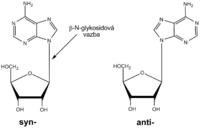
Sloučenina dusíkaté báze se sacharidem se nazývá nukleosid, podle pentózy ribonukleosid (konkrétně adenosin, guanosin, cytidin, thymidin) nebo deoxyribonukleosid (deoxyadenosin, deoxyguanosin, deoxycytidin, deoxyuridin). Heterocykly bazí jsou ploché, jejich rovina je přibližně kolmá k rovině furanózového kruhu pentózy. Na první pohled se zdá, že báze může vzhledem k pentóze rotovat kolem glykosidové vazby. Sterické zábrany však umožňují zaujmout pouze syn- nebo anti- konformaci, podle toho, zda je báze kolem glykosidové vazby otočena nad plochu pentózy (syn-) nebo na stranu opačnou (anti-). V přirozené dsDNA převládá anti- konformace purinů i pyrimidinů.
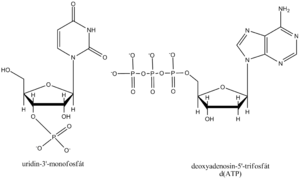
Esterifikací sacharidu kyselinou trihydrogenfosforečnou z nukleosidu vzniká nukleotid. V ribonukleotidech může být fosfát navázán v poloze 2’, 3’ nebo 5’, v deoxyribonukleotidech v poloze 3’ nebo 5’.
Vzhledem ke složitosti vzorců a délce názvů složek nukleových kyselin nomenklaturní komise Mezinárodní unie pro čistou a použitou chemii (IUPAC) stanovila pravidla pro užívání názvů, zkratek jedno- nebo třípísmenových symbolů. Nejužívanější z nich uvádí tabulka:
| Baze | Ribonukleosid | Deoxyribonukleosid | |||||
|---|---|---|---|---|---|---|---|
| N | dN | ||||||
| Pyrimidinové | Pyr | -idin | Y | Pyd | Deoxy- -idin | dY | dPyd |
| Cytosin | Cyt | Cytidin | C | Cyd | Deoxycytidin | dC | dCyd |
| Uracil | Ura | Uridin | U | Urd | Deoxyuridin | dU | dUrd |
| Thymin | Thy | Ribosylthymin | T | Thd | (Deoxy)thymidin | dT | dThd |
| Purinové | Pur | -osin | R | Puo | Deoxy- -osin | dR | dPud |
| Adenin | Ade | Adenosin | A | Ado | Deoxyadenosin | dA | dAdo |
| Guanin | Gua | Guanosin | G | Guo | Deoxyguanosin | dG | dGuo |
| Hypoxantin | Hyp | Inosin | I | Ino | |||
| Xantin | Xan | Xantosin | X | Xao | |||
| Orotát | Oro | Orotodin | O | Ord | |||
Příklady[upravit | editovat zdroj]
| Uridin-5’-fosfát | Urd-5’-P | UMP |
| Uridin-3’-fosfát | Urd-3’-P | |
| Adenosin-5’-difosfát | Ado-5’-PP | ADP |
| Adenosin-5’-trifosfát | Ado-5’-PPP | ATP |
| Cyklický adenosin-3’,5’-fosfát | Ado-3’,5’-P | cAMP |
| Deoxycytidin-5’-fosfát | dCyd-5’-P | dCMP |
| Izoakceptorové RNA | tRNA1AA, tRNA2AA, tRNA5AA | |
| Aminoacyl-tRNA | AA-tRNA | |
| Heterogenní jaderná RNA | hnRNA | |
| Malá jaderná RNA | snRNA (small nuclear RNA) | |
| Malá jadérková RNA | snoRNA (small nucleolar RNA) | |
| DNA komplementární k mRNA | cDNA |
Poznámky k tabulce:
- Komise IUPAC rezervovala jednopísmenové symboly C, T, A, G apod. pro nukleosidy zařazené v oligo- nebo polynukleotidu. Píše se CpUpGpAp nebo C–U–G–Ap v případě RNA a d(pApGpT) nebo d(pA–G–T) v případě DNA. Fosfáty (a koncové fosfáty) se značí malým písmenem p. Pokud není polarita řetězce udána čísly nebo šipkami mezi písmeny, pak 5’-konec řetězce se v zápisu nalézá vlevo a 3’-konec vpravo. Je-li na některém konci symbol p, znamená to, že koncová 5’- nebo 3’-OH skupina je esterifikována fosfátem. Jednopísmenové symboly se nepoužívají pro mononukleotidy; ty se mohou popisovat pouze třípísmenovými symboly a fosfát je zapisován jako velké písmeno P.
- Předpona deoxy- se zpravidla u thymidinu vynechává, takže dT je thymidin. T je ribosylthymin, vyskytuje se např. v transferových RNA.
- Zkratky ATP, CDP, dGMP jsou rezervovány pouze pro nukleosid-5’-fosfáty, nikoli 3’- nebo 2’-fosfáty. První fosfát, označovaný jako α, je na pentózu napojen esterovou vazbou, druhý (β) a třetí (γ) fosfát tvoří s předchozím fosfátem anhydrid.
- Fosfát se může fosfodiesterovou vazbou vázat na dva uhlíky téže pentózy, čímž vzniká ve sloučenině další heterocyklus, proto se sloučenina nazývá cyklický nukleotid. Zkratkami cAMP a cGMP se označují příslušné 3’,5’-fosfáty; mají významnou signální funkci v buňce.
Minoritní báze[upravit | editovat zdroj]
Vedle uvedených základních složek se v nukleových kyselinách vyskytují další, tzv.minoritní báze a nukleosidy. Většinou vznikají dodatečnou metylací báze nebo pentózy po jejich vestavění do polynukleotidu, existuje např. N-6-metyladenosin (m6A), 5-metylcytosin (m5C), 2’-O-metylguanosin (Gm). V transferových RNA se nachází dihydrouracil a thyminribosid. Minoritní báze a nukleosidy se asi účastní tvorby signálních míst nebo jejich substituenty chrání nukleovou kyselinu před štěpením nukleázami. Další báze jsou metabolity základních bází, např. hypoxantin (6-oxopurin), xantin (2,6-dioxopurin) a kyselina močová (2,6,8-trioxopurin). Metylxantiny kofein (1,3,7-trimetylxantin), theofyllin (1,3-dimetylxantin) a theobromin (3,7-dimetylxantin) jsou farmakologicky účinné látky rostlinného původu.
Tautomerie bazí a jejich další vlastnosti[upravit | editovat zdroj]
Z vlastností bazí je významná jejich tautomerie, kdy se izomery liší rozložením elektronů a protonů v molekule. Tato skutečnost je umožněna aromatickým charakterem heterocyklických kruhů, které existují v tautomerní rovnováze. U aminoskupin pozorujeme amino/imino tautomerii, u oxoskupin máme keto/enol tautomery. [1]
V buňce při pH kolem 7 převažuje laktamová forma u uracilu, guaninu a thyminu a laktimová forma u cytosinu a adeninu. Tautomerie je důležitá pro správné párování bazí ve dvouřetězcových nukleových kyselinách.
Další vlastností bazí je jejich charakteristické spektrum s maximem λ=260 nm. Je využíváno v řadě metodických přístupů ke studiu nukleových kyselin (čistota preparátu nukleových kyselin, jejich koncentrace, denaturace apod.)
Odkazy[upravit | editovat zdroj]
Související články[upravit | editovat zdroj]
- Struktura nukleových kyselin
- Primární struktura nukleových kyselin
- Štěpení nukleové kyseliny hydrolýzou
- Metody sekvencování
- Sekundární struktura DNA
- Denaturace nukleových kyselin, molekulární hybridizace
- Sekundární struktura RNA
- Topologie DNA
- Interakce DNA s proteiny
- Bakteriální chromozom
- Eukaryotické chromosomy
- DNA mitochondrií
Zdroje[upravit | editovat zdroj]
- ŠTÍPEK, Stanislav. Stručná biochemie : Uchování a exprese genetické informace. 1. vydání. Medprint, 1998. 92 s. s. 8–11. ISBN 80-902036-2-0.
- ↑ MURRAY, Robert K. Harperova Biochemie. 23. vydání. Jihlava : Nakladatelství H+H, 2002. ISBN 80-7319-013-3.