Translace
Translace neboli proteosyntéza je překlad nukleotidové sekvence mRNA do sekvence aminokyselin proteinu. Proces probíhá na ribozomech a jednotlivé aminokyseliny se zařazují podle pravidel genetického kódu.
Pro translaci jsou zapotřebí:
- mRNA;
- tRNA s navázanými aminokyselinami z cytoplazmy;
- součásti ribozomu a bílkoviny podmiňující jednotlivé reakce (eIF, GTP, ATP atd.).
Prokaryota vs. eukaryota[upravit | editovat zdroj]
- U prokaryot
- translace probíhá současně s transkripcí, tedy na jednom konci vznikající molekuly mRNA probíhá již translace, zatímco na druhém ještě pokračuje transkripce.
- U eukaryot
- vzniká transkripcí hnRNA (pre-mRNA), která se poté posttranskripčně úpravuje. Definitivní molekula mRNA se transportuje z jádra do cytoplazmy pomocí transportních proteinů. Až pak se váže n a součásti ribozomu a zahajuje se translace.
Bílkoviny, které mají zůstat v buňce, vznikají na volných ribosomech, zatímco na ribosomech endoplazmatického retikula se syntetizují proteiny, které pak buňka transportuje do extracelulárního prostoru.
Průběh translace[upravit | editovat zdroj]
Na jednu molekulu mRNA většinou nasedá několik Ribozomů za sebou, takže vzniká polyzom. Za optimálních podmínek translace probíhá rychlostí až 40 zařazených aminokyselin za sekundu. Chybně se zařadí méně než 1 % aminokyselin.
Přediniciační proces[upravit | editovat zdroj]
- Před zahájením translace musí být aktivovány aminokyseliny, k čemuž je využívána energie z ATP;
- aktivované AMK jsou pak enzymy aminoacyl-tRNA-syntetázami připojeny na 3’OH konec své tRNA.
Iniciace[upravit | editovat zdroj]
- Při translaci se u eukaryot uplatňuje řada proteinů zvaných eukaryotické iniciační faktory (eIF, číselně rozlišovány);
- proteosyntéza (bavíme se pouze o eukaryotech) je zahájena spojením:
- iniciační tRNA (zvláštní tRNA přenášející AMK Methionin: Met-tRNAiMet);
- GTP (potřebný zdroj energie);
- eIF2 (viz výše) do komplexu;
- komplex je navázán na malou podjednotku (40S) ribosomu;
- potom je za účasti dalších eIF k této malé podjednotce ribosomu připojena molekula mRNA, kdy významnou roli hraje její „čepička“ (7-methyl-guanosin) a na ní navázané eIF4E a eIF4G;
- za pomoci energie získané štěpením ATP se molekula mRNA posunuje od 5’ konce po malé jednotce ribosomu tak dlouho, dokud nenarazí na první triplet AUG (triplet pro Met) → dojde k otevření čtecího rámce (mechanismus zajišťující čtení informace po trojicích basí mRNA) a zahájení translace;
- vzniklý komplex je následně spojen s větší podjednotkou ribosomu za pomoci energie uvolněné štěpením GTP a zároveň dochází k uvolnění eIF;
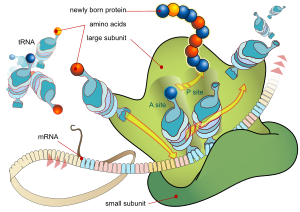
- → takto vzniká kompletní ribosom, kde:
- Met-tRNAiMet je lokalizována na peptidovém místě (P site).
Elongace[upravit | editovat zdroj]
- na aminokyselinové místo (A site) je pomocí elongačního faktoru (EFα) a energie z GTP zařazena tRNA odpovídající druhému tripletu mRNA;
- na ribosomu jsou současně dvě AMK napojené na své tRNA;
- na ribosomu popisujeme P (proteinové) místo, A (aminokyselinové místo) místo a E místo (exit):
- P místo je vazebná oblast pro tRNA nesoucí peptid;
- A místo je oblast, kam se váže nová tRNA s novou AMK;
- E místo je místo pro prázdnou (deacylovanou) tRNA, odkud se uvolní
- na začátku se tRNA nesoucí AMK metionin dostane na P místo → za pomoci řady ribosomálních peptidů dochází k vytvoření nukleofilní ataky aminokyseliny z místa A na aminokyselinu v místě P peptidické vazby mezi karboxylovou skupinou methioninu a aminoskupinou druhé AMK (tRNA této AMK se navázala na A místo) → pak je Met uvolněn ze své tRNA a současně dochází k přesunu druhé AMK (tato AMK je již spojena s metioninem peptidickou vazbou) se svou tRNA z A na P místo → tímto se celý komplex posune o trojici basí k 3’ konci mRNA → na A místo je podle pravidel genetického kódu zařazena další tRNA se svojí AMK.
Terminace[upravit | editovat zdroj]
- celý děj (systém kodon na mRNA – antikodon na tRNA) se opakuje až do doby, než je na molekule mRNA nalezen některý stop-kodon = terminační kodon (UAA, UAG, UGA);
- pak nastupuje další bílkovinný faktor (RF), který hotový polypeptid uvolní z ribosomálního komplexu.
Posttranslační úpravy[upravit | editovat zdroj]
K tomu, aby se nově syntetizovaný polypeptid stal funkčním, prochází řadou úprav:
- běžnou posttranslační úpravou je odstranění prvního methioninu z N konce polypeptidu
- dále např. kovalentní připojení chemických skupin a rozštěpení polypeptidu
Chemické modifikace proteinu zahrnují[upravit | editovat zdroj]
- methylace
- fosforylace
- acetylace
- připojení větších molekulárních struktur na postranní řetězce aminokyselin
- lipidy
- oligosacharidy (glykosylace)
Posttranslační úpravy souvisí s funkcí, kterou má protein vykonávat[upravit | editovat zdroj]
- glykosylace
- typická pro proteiny, které jsou sekretovány z buňky nebo transportovány do lysozomů, Golgiho aparátu nebo plasmatické membrány
- lipidy
- lipidové skupiny jsou přidávány zejména na membránové proteiny
- slouží k zakotvení proteinu
- rozštěpení
- při rozštěpení polypeptidu může docházet k odstranění vnitřních peptidů nebo signálních peptidů na N konci (methionin)
Proteiny, které mají být secernovány (např. hormony) nebo dopraveny do určité oblasti buňky (histony do jádra, DNA-polymerázy též) musí být opatřeny určitou signální sekvencí (signálním peptidem).
- tato signální sekvence se nazývá vedoucí sekvence (leader), tvoří ji 15-30 AMK uspořádaných do spirálovité vlásenky
- po dopravení proteinu na správné místo je odštěpena speciální peptidázou
Proteiny určené k sekreci jsou nejdříve dopraveny do endoplasmatického retikula (ER) pomocí signální rozpoznávací partikule (SRP) – komplex malých cytoplasmatických RNA a proteinů
- tento komplex se váže na rostoucí polypeptid a ribosom a prostřednictvím SRP receptoru na povrchu drsného ER (dokovací protein) se dostává do lumen ER a poté ven z buňky
- podobně jsou další proteiny nasměrovány do různých cílových míst prostřednictvím jiných signálních sekvencí (např. jaderné lokalizační signály – transport do jádra, lysozomální proteiny – transport do Golgiho aparátu a do lysozomu apod.)
Transport proteinů[upravit | editovat zdroj]
- mnohé z polypeptidů vznikajících procesem proteosyntézy mají své uplatnění na jiném místě, než je místo jejich vzniku;
- k transportu je využíván prostor endoplazmatického retikula;
- dochází ke kotranslační regresi, kdy na začátku translace je signální peptid (obsahující 15–30 AMK) konformován do tvaru spirálovité vlásenky, která se zachytí do dvouvrstvy membrány endoplazmatického retikula (ER) → pak je zahájen transport;
- v průběhu další translace je pak tento signální peptid oddělen;
- jakmile se dostane do lumen ER, je dále modifikován;
- translace je řízena pomocí SRP (signál rozpoznávající partikule):
- jde o komplex 7SL RNA a 6 různých proteinů;
- má schopnost se navázat na ribosom a zastavit další translaci až do doby, než se dokáže dostat do kontaktu s tzv. dokujícím proteinem, který tvoří součást membrány ER → tím se uvolní z vazby na ribosom a translace může pokračovat dál.
Odkazy[upravit | editovat zdroj]
Související články[upravit | editovat zdroj]
- Translace u eukaryot
- Translace u prokaryot
- Transkripční faktory
- Transkripce
- Posttranskripční úpravy
- Posttranslační úpravy
- RNA
Externí odkazy[upravit | editovat zdroj]
Zdroj[upravit | editovat zdroj]
- ŠTEFÁNEK, Jiří. Medicína, nemoci, studium na 1. LF UK [online]. [cit. 11.02.2010]. <http://www.stefajir.cz>.
Použitá literatura[upravit | editovat zdroj]
- MURRAY, Robert K., Daryl K. GRANNER a Peter A. MAYES, et al. Harper’s Biochemistry. 23.. vydání. Appleton & Lange, 1993. ISBN 0-8385-3562-3.
- ALBERTS, Bruce, Alexander JOHNSON a Julian LEWIS, et al. Molecular Biology of the Cell [online] . 5.. vydání. Garland, 2007. Dostupné také z <https://www.ncbi.nlm.nih.gov/books/br.fcgi?book=mboc4>. ISBN 978-0-8153-4111-6.