Antikoagulancia
Antikoagulancia jsou léčiva snižující srážlivost krve. Svým působením blokují koagulační faktory, a tím i vlastní koagulaci (laicky se hovoří o „ředění krve“). Používají se především k profylaxi žilní a nitrosrdeční trombózy a následné embolie. Laboratorně se využívají jako protisrážlivá činidla.
Ideální antikoagulans by mělo:
- být aplikovatelné p.o. i parenterálně;
- mít rychlý nástup účinku;
- mít predikovatelné vlastnosti, a proto fixní dávkování;
- být bezpečné;
- mít dostupné antidotum;
- být bez interakcí s jinými léky nebo potravinami.
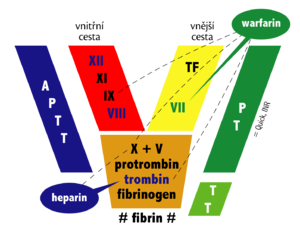
Obecně má v koagulační kaskádě klíčovou úlohu faktor IIa (trombin), který má prokoagulační i regulační účinky. Např. navázáním na trombomodulin dochází ke změně substrátové specificity trombinu, který pak nepolymerizuje fibrin, ale aktivuje protein C/S. Zároveň komplex trombin/trombomodulin aktivuje i inhibitor fibrinolýzy TAFI brzdící spontánní fibrinolýzu.
Jak bude rozvedeno dále, současná antikoagulační terapie ovlivňuje krevní srážlivost v zásadě třemi způsoby – inhibicí aktivace trombinu (hirudiny a gatrany), inhibicí aktivace Xa (pentasacharidy, hepariny, xabany) či inhibicí více koagulačních faktorů najednou (warfarin) a to přímými i nepřímými mechanismy.
Je dobré mít na paměti, že inhibice trombinu a faktoru Xa má sice srovnatelný účinek na výsledné ovlivnění koagulační kaskády, nicméně není vždy srovnatelný účinek na fibrinolýzu a tvorbu proteinu C/S. Z toho vyplývá např. rozdíl v profylaxi infarktu myokardu, kdy je např. efekt gatranů menší než xabanů.
Klasifikace[upravit | editovat zdroj]
Antikoagulancia lze rozdělit na látky používané in vivo (pacient) a látky používané in vitro (laboratoř).
| Antikoagulanci používaná in vivo | Antikoagulancia používaná in vitro |
|---|---|
|
|
Dále lze antikoagulancia rozdělit podle jejich mechanismu účinku na přímá a nepřímá. Přímá antikoagulancia inaktivují samotné koagulační faktory přítomné v plazmě, zatímco nepřímá antikoagulancia ovlivňují koagulační faktory snížením jejich tvorby v játrech.
| Přímá antikoagulancia | Nepřímá antikoagulancia | |
|---|---|---|
| Přímé inhibitory trombinu / faktoru Xa |
Nepřímé inhibitory trombinu / faktoru Xa | |
|
|
|
Přímá antikoagulancia[upravit | editovat zdroj]
Přímá antikoangulancia blokují především trombin a/nebo faktor Xa. Trombin je klíčový protein koagulační kaskády, který aktivuje řadu koagulačních faktorů, a zejména katalyzuje přeměnu fibrinogenu na nerozpustný fibrin. Dělíme je na přímé a nepřímé inhibitory trombinu/faktoru Xa.
Nepřímé inhibitory trombinu/faktoru Xa[upravit | editovat zdroj]
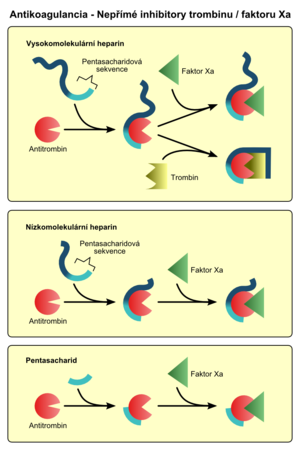
Působí prostřednictvím aktivace přirozeného inhibitoru trombinu – antitrombinu (AT III). Jsou tudíž závislé na přítomnosti endogenních inhibitorů. Tak fungují např. hepariny. Mohou aktivovat i další regulační proteiny, např. heparinový faktor II. Molekula nepřímého inhibitoru se opakovaně uvolňuje a váže na další molekuly AT III (1 molekula heparinu aktivuje až 1000 molekul AT III).
Chemicky jde o glykosaminoglykany tvořené řetězcem hexóz/pentóz s opakujícími se sekvencemi modifikovaných disacharidových jednotek lineárně spojených. Všechny mají silný negativní náboj, kdy po navázání na proteiny s pozitivním nábojem dojde ke konformační změně a aktivaci příslušných molekul. Zároveň se aktivují i reparační pochody (jedna z fyziologických funkcí heparinu a dalších působků).
Vhodné je myslet na možnost deficience AT III (1 % populace) či stavy zvýšené resorpce AT III (při dlouhodobém napojení na mimotělní oběh, DIC), což vede k selhání léčby. Hepariny taktéž účinkují pouze na trombin volně dostupný v krvi. Trombin, který už je součástí fibrinové zátky, není léčbou ovlivněn.
Základními indikacemi jsou krátkodobá antikoagulační léčba u akutních stavů (akutní koronární syndrom, plicní embolie), prevence tromboembolismu při hemodialýze a krátkodobá prevence tromboembolické nemoci (např. po operaci).
Farmakokinetika[upravit | editovat zdroj]
Farmakokinetické vlastnosti, včetně biologické dostupnosti a renální clearance, ovlivňuje délka řetězce. Aplikují se pouze i.v. (heparin) nebo s.c. (frakcionované hepariny). Nejdelší řetězec má heparin, kratší nízkomolekulární hepariny, nejkratší řetězec mají pentasacharidy. Platí přitom, že čím kratší je řetězec léčiva, tím více je inhibován faktor Xa, a tím méně je inhibován trombin. Zároveň čím menší je molekula léčiva, tím větší je závislost na eliminaci ledvinami, což je důležité u pacientů s renální insuficiencí.
Nežádoucí účinky[upravit | editovat zdroj]
Na předním místě nežádoucích účinků najdeme zvýšenou krvácivost (místa vpichu, rány, epistaxe, hematurie, metroragie). Kontraindikací jsou tedy krvácivé stavy. Zvýšená pozornost je kvůli zvýšenému riziku krvácení nutná při současném podávání antiagregancií a nesteroidních antiflogistik. Nevhodné je i.m. podání kvůli riziku krvácení do svalu. Možnou komplikací je heparinem indukovaná trombocytopenie (HIT). Rozlišujeme málo závažnou HIT I, typu rozvíjející se 2. až 4. den aplikace a vzácnější, ovšem závažnou autoimunitní HIT II. typu. Ta se rozvíjí spíše 5. až 10. den aplikace na podklade imunitní reakce na komplex heparin/destičkový faktor 4. To působí buď protrombotický, nebo prokoagulační stav. Základem léčby jsou kortikoidy. Mezi další možné nežádoucí účinky patří hypersenzitivita, u nefrakcionovaného heparinu při dlouhodobém užívání osteoporóza.
Heparin a jeho deriváty[upravit | editovat zdroj]
Heparin je směs kyselých mukopolysacharidů, běžně se vyskytujících v organismu. Terapeuticky se využívá heparin nefrakcionovaný, nízkomolekulární a pentasacharidy.
Nefrakcionovaný heparin (UFH)[upravit | editovat zdroj]
Nefrakcionovaný (přirozený) heparin (UFH z anglického Unfractionated Heparin) aktivuje AT III, který inaktivuje trombin a některé další koagulační faktory (např. faktor Xa). Jde o směs různě dlouhých řetězců s alespoň 18 podjednotkami. Má následující vlastnosti:
- neprochází placentou, a proto je vhodný pro použití v těhotenství;
- má specifické antidotum – protamin sulfát;
- má non-antitrombotický efekt (podpora reparace, inhibice osteogeneze, inhibice nádorové diseminace aj.)
- váže se na plazmatické bílkoviny,
- špatně se vstřebává, podává se i. v., kdy je účinek téměř okamžitý (při s.c. aplikaci nastupuje účinek cca po 2 hodinách[1]);
- působí krátkodobě a má variabilní biodegradaci (v závislosti na depolymerační kapacitě makrofágů), proto je třeba pravidelně po 6 hodinách kontrolovat APTT a nutné monitorovat i počet trombocytů (riziko HIT).
Nízkomolekulární hepariny[upravit | editovat zdroj]
Nízkomolekulární, frakcionované, hepariny (LMWH, low molecular weight heparin) mají kratší řetězce vzniklé rozštěpením heparinu (o délce 5 až 17 podjednotek). Působí podobně jako nefrakcionovaný heparin (inaktivují však především faktor Xa), ale jsou bezpečnější, mají lepší antikoagulační účinek, méně nežádoucích účinků a výhodnější farmakokinetiku. Nízkomolekulární hepariny:
- se lépe vstřebávají, aplikují se s.c. (většinou do břicha);
- mají delší účinek a poločas (aplikují se 1 až 2x denně);
- mají nižší riziko indukované trombocytopenie;
- nemusí se kontrolovat APTT, pokud nutná monitorace účinku, monitoruje se Anti-Xa;
V praxi se používá zejména enoxaparin![]() , nadroparin
, nadroparin![]() , dalteparin
, dalteparin![]()
Pentasacharidy[upravit | editovat zdroj]
Pentasacharidy jsou synteticky připravené řetězce pěti sacharidových jednotek, odvozené od heparinu. Prostřednictvím AT III inaktivují faktor Xa. Pentasacharidy:
- mají širší terapeutické okno – jsou bezpečnější a mají jednoduché dávkování;
- mají dlouhý a předvídatelný efekt,
- jsou nákladné (cca 2× dražší proti nízkomolekulárním heparinům);
- nemají specifické antidotum.
Příkladem používané látky je fondaparinux![]() , idraparinux je ve vývoji.
, idraparinux je ve vývoji.
Přímé inhibitory trombinu/faktoru Xa[upravit | editovat zdroj]
Váží se na trombin nebo faktor Xa a tím selektivně (a kompetitivně) blokují jejich funkci. Patří k nim xabany, gatrany a hirudiny. Indikovány jsou jakožto profylaxe tromboembolických příhod, léčba akutní žilní trombózy a jako léčba plicní embolie. Dle nových doporučení jsou také antikoagulancii první volby u pacientů s fibrilací síní (pokud nemají mechanickou náhradu srdeční chlopně nebo porevmatickou chlopenní vadu). Nejčastějším nežádoucím účinkem je stejně jako u heparinu a jeho derivátů krvácivost. U gatranů pozorujeme menší krvácení až v 10 %. Krvácení do GIT je u NOAC obecně o něco častější než u warfarinu, ale mají mnohem nižší výskyt intrakraniálních krvácení. Opěr je nutná opatrnost při současném užívání antiagregancií, NSAID nebo glukokortikoidů kvůli vyššímu riziku krvácivých komplikací.
Hirudiny[upravit | editovat zdroj]
Hirudin![]() je přírodní antikoagulační peptid produkovaný pijavicemi (Hirudo medicinalis). Má dobré vlastnosti, ale je drahý. V současné době několik výrobců dodává rekombinantně vyrobené deriváty hirudinu, které na rozdíl od přírozeně se vyskytujícího peptidu postrádají sulfátovou skupinu – desirudin[2]
je přírodní antikoagulační peptid produkovaný pijavicemi (Hirudo medicinalis). Má dobré vlastnosti, ale je drahý. V současné době několik výrobců dodává rekombinantně vyrobené deriváty hirudinu, které na rozdíl od přírozeně se vyskytujícího peptidu postrádají sulfátovou skupinu – desirudin[2]
NOAC (novel oral anticoagulants) − nová perorální antikoagulancia[upravit | editovat zdroj]
Gatrany[upravit | editovat zdroj]
Gatrany přímo inhibují trombin. U nás je registrovaný dabigatran![]() . Podává se p.o., má rychlý nástup účinku a dlouhodobé působení. Dá se použít v profylaxi trombembolické nemoci (srovnatelný s enoxaparinem) a fibrilace síní (lepší než warfarin). Používá s v ortopedických indikacích a při prevenci cévní mozkové příhody a systémové embolie u dospělých pacientů s nevalvulární fibrilací síní.
. Podává se p.o., má rychlý nástup účinku a dlouhodobé působení. Dá se použít v profylaxi trombembolické nemoci (srovnatelný s enoxaparinem) a fibrilace síní (lepší než warfarin). Používá s v ortopedických indikacích a při prevenci cévní mozkové příhody a systémové embolie u dospělých pacientů s nevalvulární fibrilací síní.
Z důvodu lepší absorpce podáván jako proléčivo, které je substrátem eliminační pumpy glykoprotein P. V závislosti na polymorfismu pumpy a užívání aktivátorů či inhibitorů pumpy (např. makrolidy, amiodaron, verapamil, grapefruit) může kolísat biologická dostupnost gatranů. Eliminace probíhá hlavně přes ledviny. Při renálním selhání (GFR<30 ml/min), užívání silných inhibitorů glykoproteinu P, graviditě a laktaci jsou kontraindikovány. Někdy je nutná úprava dávky také dle hmotnosti, věku a pohlaví. Gatrany mají ovšem výhodu v podobě absence interakcí na úrovni CYP3A4. Pokud musíme monitorovat jejich účinek, hodnotíme aPTT a diluční trombinový čas.
Nadějně vypadající předchůdce dabigatranu ximelagatran byl pro hepatotoxicitu v roce 2006 stažen z klinické praxe[3].
Xabany[upravit | editovat zdroj]
Xabany přímo inhibují faktor Xa. Od roku 2009 je u nás registrovaný rivaroxaban![]() . Podává se p. o., je prediktabilní, indikace jsou obdobné jako u dabigatranu. Nověji je pak registrovaný apixaban
. Podává se p. o., je prediktabilní, indikace jsou obdobné jako u dabigatranu. Nověji je pak registrovaný apixaban![]() a edoxaban
a edoxaban![]() .
.
Nástup účinku již za 30 minut. Oproti gatranům je výhodná nízká afinita k eliminačnímu glykoproteinu P. Hlavně rivaroxaban a apixaban jsou z většiny vázány na transportní bílkoviny. Poločas je u jednotlivých zástupců rozdílný, pohybuje se od 5 do 14 hodin v závislosti na věku a přípravku. Eliminace není tak závislá na ledvinách jako u gatranů (apixapan a rivaroxabanu eliminace převážně játry, u edoxabanu 50:50 s ledvinami),
Stejně jako u gatranů jsou kontraindikovány u těžkého renálního selhání, léčbě silnými inhibitory transportních a metabolických systémů (makrolidy, azolová antimykokotika, antiretrovirotika) a aktivním krvácení. Při nutnosti monitorace stanovujeme anti-Xa.
Nepřímá antikoagulancia[upravit | editovat zdroj]
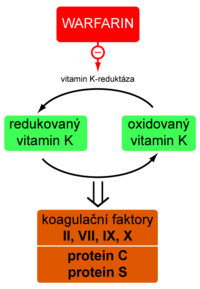
Nepřímá antikoagulancia jsou kompetitivní antagonisté vitaminu K (mají podobnou strukturu). Výsledkem jejich působení je snížení tvorby vitamin K-dependentních koagulačních faktorů.
Redukovaný vitamin K je oxidován během syntézy faktorů II, VII, IX, X a antikoagulačních proteinů C a S. Oxidovanou formu pak musí zregenerovat vitamin K reduktáza – enzym, jenž je cílovou strukturou, kterou nepřímá antikoagulancia blokují. Z výše uvedeného je zřejmé, že tyto látky jsou účinné výhradně in vivo. Vrchol antikoagulačního účinku nastupuje asi za 3 dny.
Účinnost antikoagulační terapie může být ovlivněna množstvím vitaminu K v potravě nebo jeho vstřebáváním. Mimo potravinových interakcí existuje i celá řada interakcích lékových, založených na ovlivnění biotransformace léčiva, syntézy a degradace koagulačních faktorů nebo vytěsnění léčiva z vazby na albumin.
Nežádoucím účinkem nepřímých antikoagulancií je krvácení. Objeví-li se, je třeba lék vysadit; je možné podat vitamin K, plazmu nebo koncentrát koagulačních faktorů.
Warfarin[upravit | editovat zdroj]
Warfarin je kumarinový derivát. Byl dlouhou dobu víceméně jediným použitelným perorálním antikoagulanciem. Zpočátku se používal jako jed na krysy, ale možnosti jeho potenciálního využití odhalil sebevražedný pokus, jenž byl sledován poruchou krevní srážlivosti.
- Variabilita
Ve farmakokinetice warfarinu jsou velké interindividuální rozdíly, proto je třeba dávku přísně individualizovat. Uplatňuje se polymorfismus vitamin K reduktázy a systému CYP2C9. Interagují léčiva (zejm. amiodaron, fluvastatin, klopidogrel, nesteroidní antirevmatika, …) a potraviny s obsahem vitaminu K (listová zelenina, maso dobytka přikrmovaného vitaminem K). V dietě by proto mělo být zastoupení těchto potravin pokud možno konstantní.
Polymorfismus CYP2C9 lze dnes rutinně laboratorně stanovit.
- Vedení léčby
Na začátku léčby dochází ke krátkodobému prokoagulačnímu účinku warfarinu, protože se poněkud sníží syntéza proteinu C a S. Tuto periodu je proto třeba krýt aplikací nízkomolekulárního heparinu. Začíná se dávkou 5 mg/den (s překrytím LMWH). Dávkování se pak upravuje dle výsledků INR (Quick).
Jak již bylo řečeno, účinek warfarinu kolísá. Proto je nutné pravidelně kontrolovat INR, které by se mělo pohybovat v rozmezí 2–3,5. Měření by se mělo provádět jednou za 3–5 dní, u stabilních pacientů (tj. 2× po sobě v normě) jednou za 4 týdny. Aktuálním trendem je domácí monitorování jednou týdně.
Indikace: profylaxe trombózy a embolie u fibrilace síní, po implantaci mechanických chlopenních protéz a u flebotrombózy.
Kontraindikace: krvácivé stavy, gravidita (při dávkách nad 5 mg/den převedení na LMWH).
Při krvácení je nutné přerušit léčbu, případně podat čerstvou mraženou plasmu, vitamin K či komplex koagulačních faktorů.
Ethylbiscumacetát (Pelentan®) je původní československý přípravek. Je velmi nestabilní a již není v ČR registrován[1].
Odkazy[upravit | editovat zdroj]
Související články[upravit | editovat zdroj]
- Prothromplex
- Heparin
- Warfarin
- Fibrinolytika
- Hemokoagulace
- Cirkulující antikoagulancia
- Trombóza
- Vyšetření krvácivosti
- Vyšetření krevní srážlivosti
- HAS-BLED skóre
Zdroj[upravit | editovat zdroj]
- BULTAS, Jan. Kurz Farmakoterapie kardiovaskulárních chorob. 3. LF UK, 2010.
Reference[upravit | editovat zdroj]
- ↑ a b LINCOVÁ, Dagmar a Hassan FARGHALI, et al. Základní a aplikovaná farmakologie. 2.. vydání. Praha : Galén, 2007. 672 s. s. 272–277. ISBN 978-80-7262-373-0.
- ↑ MAREK, Josef, et al. Farmakoterapie vnitřních nemocí. 3.. vydání. Praha : Grada Publishing, 2005. 773 s. s. 302-303. ISBN 80-247-0839-6.
- ↑ NOVOTNÝ, Jan. Nové antitrombotické léky. Interní medicína pro praxi [online]. 2006, roč. 8, no. 7–8, s. 327–329, dostupné také z <http://www.solen.cz/pdfs/int/2006/07/04.pdf>. ISSN 1212-7299.
Použitá literatura[upravit | editovat zdroj]
- LINCOVÁ, Dagmar a Hassan FARGHALI, et al. Základní a aplikovaná farmakologie. 2.. vydání. Praha : Galén, 2007. 672 s. s. 272–277. ISBN 978-80-7262-373-0.
- TROJAN, Stanislav, et al. Lékařská fyziologie. 4. vydání. Praha : Grada, 2004. 772 s. ISBN 80-247-0512-5.
- HYNIE, Sixtus. Farmakologie v kostce. 2. vydání. Praha : Triton, 2000. 520 s. ISBN 80-7254-181-1.