Ionizace
Ionizace je termín používaný pro proces vzniku iontů, tedy elektricky nabitých částic, z původně elektricky neutrálních atomů či molekul.
Historie[upravit | editovat zdroj]
Slovo ion (říkáme 1 ion, ale 2 ionty) pochází z řeckého ἰόν znamenajícího chodící, putující, a bylo poprvé použito Michaelem Faradayem, jenž jím naznačil hlavní vlastnost iontů, tedy to, že se díky svému náboji pohybují v roztoku mezi elektrodami (kladné ke katodě, záporné k anodě).
Způsoby ionizace[upravit | editovat zdroj]
Elektricky neutrální molekula nebo atom se může stát elektricky nabitým, tedy iontem, dvěma způsoby:
- odevzdáním elektronu (vzniká kladně nabitý ion, tedy kation)
- přijetím elektronu (vzniká záporně nabitý ion, anion)
Tvorba kationtů[upravit | editovat zdroj]
K uvolnění elektronu z jeho místa v elektronovém obalu atomu dojde, je-li mu dodána dostatečně velká energie, tedy větší, než jakou je v něm držen. Odpovídá tomu Einsteinův vztah pro fotoefekt: . Z něj je zřejmé, že část energie dodaná fotonem elektronu se spotřebuje právě na překonání této vazby (Ev) a zbytek se projeví jako kinetická energie uvolněného elektronu. Pokud energie fotonu není dostatečná, k uvolnění elektronu nedojde a může dojít pouze k jeho dočasné excitaci.
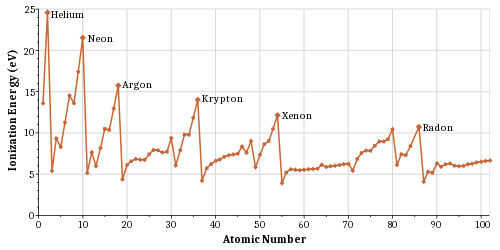
U každého atomu můžeme určit jeho ionizační energii, tedy energii potřebnou k uvolnění jednoho elektronu. Z grafu je vidět, že nejvyšší ionizační energii mají vzácné plyny díky úplnému zaplnění svých orbitalů. Energie pro uvolnění elektronu může být dodána různými způsoby. Při takzvané zářivé ionizaci se tak děje pomocí fotonu, tedy elektromagnetickým zářením. Druhou možností je ionizace srážková, kdy je elektron uvolněn po srážce s jinou částicí o vysoké kinetické energii (např. ionizační efekt záření α).
Tvorba aniontů[upravit | editovat zdroj]
K tomu, aby se elektron mohl k atomu či molekule přidat a vytvořit tak záporně nabitý anion, musí mít dostatek energie na to, aby překonal potenciálovou bariéru. Elektronový obal je totiž stejně jako tento elektron záporně nabitý, tudíž se podle Coulombova zákona odpuzují. V případě, že je energie elektronu nedostatečná, je jednoduše elektronovým obalem odpuzen. Pokud má energie dostatek, umístí se do nejnižší nezaplněné energetické hladiny a zbytek energie vyzáří ve formě elektromagnetického záření. Zdrojem elektronů s dostatečnou energií může být například β-záření.
Rekombinace[upravit | editovat zdroj]
Společně s ionizací plynu probíhá i děj opačný, tzv. rekombinace iontů, během které se opačně nabité ionty, případně kladné ionty a elektrony, spojují v neutrální molekuly plynu.
Disociace[upravit | editovat zdroj]
Ačkoli se může zdát, že například při rozpouštění kuchyňské soli dochází k tvorbě iontů Na+ a Cl-, ve skutečnosti se o ionizaci v pravém slova smyslu nejedná. Dochází zde totiž pouze k disociaci iontů, které byly již dříve iontovou vazbou vázány v krystalové mřížce NaCl.
Odkazy[upravit | editovat zdroj]
Související články[upravit | editovat zdroj]
Externí odkazy[upravit | editovat zdroj]
Zdroje[upravit | editovat zdroj]
- TOMSA, Jan. Základy ionizujícího záření [přednáška k předmětu Biofyzika, obor Všeobecné lékařství, 2. LF UK]. Praha. 27.11.2012.
- TERÁBEK, Pavol. Zmaturuj z fyziky. 1. vydání. Brno : Didaktis, 2006. ISBN 80-89160-35-2.