Elektroforéza
Elektroforéza patří mezi separační metody izolující molekuly o rozdílné hmotnosti, popř. odlišném elektrickém náboji, využívající jejich odlišnou pohyblivost v elektrickém poli.
Z historie[upravit | editovat zdroj]
Od roku 1892 je známo, že anorganické částice v koloidním roztoku působením elektrického pole nenáhodně putují. Zanedlouho poté byl tento jev popsán i u proteinů ve vodných roztocích.
V roce 1948 získal za sestavení elektroforetické aparatury NC za chemii švédský vědec Arne W. Tiselius.
Princip elektroforézy[upravit | editovat zdroj]
Elektroforéza využívá schopnosti nabitých částic pohybovat se v elektrickém poli, přičemž rychlost pohybu částic je závislá na velikosti celkového povrchového náboje, velikosti a tvaru molekuly a její koncentraci v roztoku.
Rychlost molekuly při elektroforetické separaci lze vyjádřit:
kde ζ je elektrokinetický potenciál (V), ν je lineární rychlost pohybu částice (m ·s−1), E je intenzita elektrického pole (V · m−1) a η viskozita prostředí (Pa · s), εr je relativní permitivita kapaliny, ε0 permitivita vakua, C konstanta závislá na tvaru částic a na tloušťce elektrické dvojvrstvy (např. pro kulovité částice o poloměru r a velkou efektivní tloušťku dvojvrstvy l, kde r/l < 0,1, je C = 2/3, pro tenkou dvojvrstvu (r/l > 100) je C = 1).
Aplikace elektroforézy[upravit | editovat zdroj]
Volná elektroforéza[upravit | editovat zdroj]
Volná elektroforéza se provádí ve vodných roztocích (elektrolytech), v němž částice putují k elektrodě s opačnou polaritou. Separaci může narušit vliv konvenčních proudů vznikajících vlivem tepla generovaného průchodem elektrického proudu.
Elektroforéza na nosičích[upravit | editovat zdroj]
Provádí se na hydrofilních porézních nosičích, jako je např. neklížený papír (chromatografický), acetát celulózy, agarózový gel, polyakrylamidový gel, celulóza, nezgelovatělý škrob apod. Podle materiálu se nosič může chovat jako molekulární síto, jímž procházejí velké molekuly obtížněji než malé.
Zonální elektroforéza plasmatických proteinů[upravit | editovat zdroj]
Zonální, také zónová, elektroforéza se provádí např. na acetátcelulóze. Dělení proteinů zde závisí na typu a počtu ionizovatelných skupin postranních řetězců aminokyselin a na velikosti celkového náboje proteinu (kladného nebo záporného).
Je-li pH roztoku, ve kterém elektroforéza probíhá větší, než je pI (izoelektrický bod), protein má celkově záporný náboj. Naopak, je-li pH roztoku nižší, než pI, protein má celkově kladný náboj. Odpovídá-li pH roztoku izoelektrickému bodu proteinu, ten se nepohybuje.
Gelová elektroforéza[upravit | editovat zdroj]
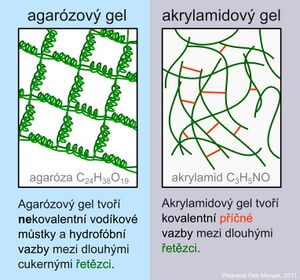
Gely tvoří přechod mezi pevným a kapalným stavem. Strukturálně je gel z více než 90 % voda. V gelu nalézáme trojrozměrnou síť, kde póry mohou sloužit jako molekulové síto. Velikost pórů odpovídá velikosti proteinů a nukleových kyselin. Nejčastější gely jsou polyakrylamidový a agarózový.
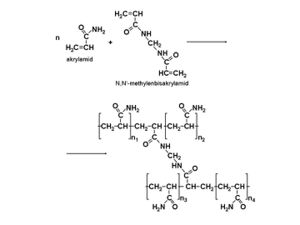
Agaróza je síť tvořená dlouhými cukernými polymery vázanými nekovalentními vodíkovými můstky a hydrofobními vazbami. Polyakrylamidové gely tvoří síť dlouhých molekul polyakrylamidu spojených příčnými můstky N,N´-metylenbisakrylamidu.
Nativní gelová elektroforéza bílkovin[upravit | editovat zdroj]
Probíhá bez denaturačních činidel. Proteiny migrují gelem podle svého celkového náboje, velikosti a tvaru. Citlivost elektroforézy je dána charakterem pórů gelu. Příkladem může být elektroforéza sérových bílkovin.
SDS gelová elektroforéza[upravit | editovat zdroj]
Proteiny jsou denaturovány dodecylsíranem sodným (SDS) a β-merkaptoetanolem, který zruší disulfidické vazby. SDS je denaturační činidlo a detergent, který proteiny obalí a denaturuje. Proteiny získají tyčinkovitý tvar a při pH 7–10 mají díky SDS všechny stejnou hustotu povrchového náboje. Jejich pohyblivost závisí téměř výhradně na molekulové hmotnosti polypeptidových řetězců. Metoda je vhodná pro analýzu makromolekulárních komplexů.
Izoelektrická fokusace[upravit | editovat zdroj]
Proteiny se dělí v gelu s pH gradientem. Migrují do bodu, kde nemají žádný povrchový náboj, tj. do místa, kde se pH rovná pI.
Dvojrozměrná elektroforéza proteinů[upravit | editovat zdroj]
2D elektroforéza umožňuje rozlišení až 10 000 proteinů. Proteiny se nejprve rozdělí podle svých izoelektrických bodů v gradientu pH. Po separaci v prvním rozměru je provedena SDS-elektroforéza v druhém směru, bílkoviny se rozdělí podle své velikosti.
Na rozdíl od předešlých metod, jejichž výsledkem jsou frakce obsahující často směs několika bílkovin, 2D elektroforéza umožňuje izolovat jednotlivé proteiny i z biologických vzorků. Výsledné mapy proteinů se mohou porovnávat s kontrolními vzorky (např. pacienti s konkrétním onemocněním a zdraví pacienti). 2D elektroforéza se používá i jako preparativní metoda: konkrétní skvrna se z gelu vystřihne, izoluje se z ní bílkovina a použije se k další analýze či jinému postupu.
Kapilární elektroforéza[upravit | editovat zdroj]
Metoda využívá pohybu elektricky nabitých látek v elektrickém proudu rozpuštěných ve vodivém médiu – kapiláře naplněné elektrolytem nebo gelem. Doprovodným jevem je elektroosmotický tok. Na vnitřním povrchu kapiláry v místě styku s vodivým roztokem vzniká elektrická dvojvrstva. Pevná část (stěna kapiláry) je nabitá nepohyblivým plošným záporným elektrickým nábojem. Z kapalné části se kladné ionty připojí ke stěně kapiláry (dvojvrstva) a ionty se pohybují ke katodě. Pohyblivá vrstvička se žene kapilárou a strhne s sebou celý průřez kapaliny v kapiláře. Roztok putuje kapilárou celý najednou (u elektroforézy putují jen ionty).
Použití elektroforézy[upravit | editovat zdroj]
Elektroforéza nalézá široké využití, například při analýze a dělení směsí bílkovin, charakterizace povrchů organizmů jako jsou bakterie, viry apod. Praktické využití při diagnostice postižení monogenních chorob atd.
Odkazy[upravit | editovat zdroj]
Související články[upravit | editovat zdroj]
Použitá literatura[upravit | editovat zdroj]
- MURRAY, Robert K, et al. Harperova biochemie. 2. vydání. Jinočany : H&H, 2002. 872 s. ISBN 80-7319-013-3.
- ALBERTS, B, D BRAY a A JOHNSON, et al. Základy buněčné biologie. 2. vydání. Ústí nad Labem : Espero Publishing, 2005. 740 s. ISBN 80-902906-2-0.
- Wikipedie. Elektroforéza [online]. ©2012. Poslední revize 2012-01-30, [cit. 2012-04-17]. <https://cs.wikipedia.org/wiki/Elektrofor%C3%A9za>.