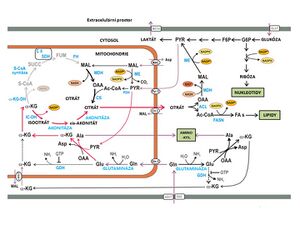
Reduktivní karboxylace
Reduktivní karboxylace (RK) představuje slibný cíl protinádorové terapie, a je tak stále předmětem výzkumu. Jedná se o metabolickou dráhu, jejíž existence byla prokázána i fyziologicky[1]. Zvlášť významná se ale zdá být v nádorových tkáních. Hraje v nich důležitou roli při adaptaci na velmi nízkou koncentraci kyslíku[2].
V současné době se výzkumem rakoviny zabývá velké množství vědeckých skupin, které jsou za jedno v tom, že metabolismus nádorových buněk funguje na principu tzv. metabolického remodelingu. Veškeré metabolické dráhy v transformovaných buňkách se využívají pro tvorbu ATP, stavebních jednotek a intermediátů potřebných k proliferaci buněk[3]. Obecně se mezi modifikované dráhy v nádorových buňkách řadí glykolýza, Krebsův cyklus, pyruvátový cyklus (karboxylace pyruvátu), lipogeneze a pentózo-fosfátový cyklus [4].
Nádorové buňky rychle proliferují a v prostředí solidního tumoru jsou vlivem pomalé (nedostatečné) angiogeneze nuceny přežít i ve velmi nízkých koncentracích kyslíku [5]. RK je reverzní dráha Krebsova cyklu, v níž z 2-oxoglutarátu vzniká izocitrát a citrát, a podílí se tak na tvorbě prekurzorů pro syntézu lipidů. Katalyzátorem je NADPH dependentní izocitrátdehydrogenáza 2 (IDH2).
Ve zkratce můžeme RK popsat takto:
- Významnou anaplerotickou dráhou RK je glutaminolýza, která produkuje 2-oxoglutarát.
- 2-oxoglutarát se (obráceně než v Krebsově cyklu) přeměňuje na izocitrát a dále zpětnou akonitázovou reakcí na citrát.
- Citrát se poté může exportovat do cytozolu, kde se ATP:citrát lyasou štěpí na acetyl-CoA a oxalacetát.
- Acetyl-CoA pak slouží jako prekurzor pro syntézu mastných kyselin a cholesterolu. Oxalacetát může být dále přeměněn na malát, který je dále metabolizován[6].
RK navazující na glutaminolýzu byla poprvé popsána v hnědém tuku [7], kde je až 90 % glutaminu zpracováno reduktivně a až 40 % lipogenního acetyl-CoA pochází právě z něj. Následně byl popsán vztah mezi RK a poškozením mitochondriálního oxidačního metabolismu[8]. Podobně jako v případě mitochondriální poruchy se i při hypoxii většina citrátu syntetizuje reduktivně z 2-oxoglutarátu, zatímco při normálním zásobování buněk kyslíkem je hlavním zdrojem citrátu glukóza[9]. K aktivaci RK tedy dochází při potlačení mitochondriální oxidativní fosforylace (hypoxií či poškozením). Dráha umožňuje udržet hladinu citrátu, která je nutná, aby se buňka mohla dělit v podmínkách se sníženou možností oxidace substrátů.
RK byla popsána i v lidských fibroblastech. Přisuzuje se jí tam i funkce jakéhosi přenašeče NADPH (člunku). NADPH v průběhu RK redukuje 2-oxoglutarát, vzniká isocitrát a následně citrát. Ten se exportuje do cytozolu, kde může být již zmíněnou IDH1 reoxidován zpět na 2-oxoglutarát, přičemž vzniká cytozolický NADPH [10]. Jelikož redukční ekvivalenty neprochází snadno skrze membrány, jedná se o další elegantní způsob mezikompartmentové transhydrogenace.
Podmínkou RK je tedy jednak přítomnost IDH2, dále takzvaný „přerušený“ Krebsův cyklus (označuje se jím reverzní dráha 2-oxoglutarát – isocitrát – citrát) a dostupnost substrátů, včetně CO2 [11]. Některé práce uvádějí, že nízký poměr koncentrací citrátu a 2-oxoglutarátu je stěžejní pro průběh reduktivní karboxylace v mitochondriích [12]. Dalším faktorem nutným pro průběh mitochondriální RK je dostupnost NADPH – směr reakce IDH2 je daný afinitou k NADPH (Km pro NADPH je nižší než pro NADP+)[13] – a přítomností enzymů participujících na RK.
Odkazy[upravit | editovat zdroj]
Reference[upravit | editovat zdroj]
- ↑ DVOŘÁK, Aleš et al. Background Levels of Neomorphic 2-hydroxyglutarate Facilitate Proliferation of Primary Fibroblasts. Physiological Research. 2017, roč. X, s. 293-304, ISSN 1802-9973.
- ↑ NAKAZAWA, Michael S. et al. Oxygen Availability and Metabolic Adaptations. Nat Rev Cancer.. 2016, roč. x, s. 663-673, ISSN 1474-175X.
- ↑ ŠPAČKOVÁ, Jitka et al. Biochemical Background in Mitochondria Affects 2HG Production by IDH2 and ADHFE1 in Breast Carcinoma. Cancers. 04/2021, roč. X, s. 1709, ISSN 2072-6694.
- ↑ TAVARERS, LC et al. Metabolic evaluations of cancer metabolism by NMR-based stable isotope tracer methodologies. Eur J Clin Invest. 2015, roč. 45, s. 37-43, ISSN 1365-2362.
- ↑ MUZ, Barbara et al. The role of hypoxia in cancer progression, angiogenesis, metastasis, and resistance to therapy. Hypoxia. 2015, roč. 3, s. 83–92, ISSN 2324-1128.
- ↑ SMOLKOVÁ, Katarína a Petr JEŽEK. The Role of Mitochondrial NADPH-Dependent Isocitrate Dehydrogenase in Cancer Cells. Int J Cell Biol. 2012, roč. X, s. xxx, ISSN Hindawi.
- ↑ YOO, H. et al. Quantifying reductive carboxylation flux of glutamine to lipid in a brown adipocyte cell line. J Biol Chem. 2008, roč. X, s. XXX, ISSN 0021-9258.
- ↑ MULLEN, AR et al. Reductive carboxylation supports growth in tumour cells with defective mitochondria. Nature. 2012, roč. X, s. 385-8, ISSN 0028-0836.
- ↑ WISE, DR et al. Hypoxia promotes isocitrate dehydrogenase-dependent carboxylation of α-ketoglutarate to citrate to support cell growth and viability. Natl Acad Sci U S A. 2011, roč. x, s. 19611-6, ISSN 0027-8424 a 1091-6490.
- ↑ LEMONS, JMS et al. Quiescent fibroblasts exhibit high metabolic activity. PLoS Biol.. 2010, roč. x, s. xxx, ISSN 1544-9173.
- ↑ SMOLKOVÁ, Katarína et al. Reductive carboxylation and 2-hydroxyglutarate formation by wild-type IDH2 in breast carcinoma cells. IJBCB. 2015, roč. 65, s. 125-133, ISSN 1357-2725.
- ↑ GAMEIRO, PA et al. In vivo HIF-mediated reductive carboxylation is regulated by citrate levels and sensitizes VHL-deficient cells to glutamine deprivation. Cell Metab. 2013, roč. 3, s. 372-85, ISSN 1932-7420 (online).
- ↑ SAZANOV, LA a JB JACKSON. Proton-translocating transhydrogenase and NAD- and NADP-linked isocitrate dehydrogenases operate in a substrate cycle which contributes to fine regulation of the tricarboxylic acid cycle activity in mitochondria. FEBS Lett. 1994, roč. x, s. xxx, ISSN 0014-5793 (print); 1873-3468 (web).