Úvod do práce v biochemické laboratoři
Měření objemů
Odměrné nádoby a další pomůcky v chemické laboratoři
Při přípravě roztoků a manipulaci s kapalinami používáme různé laboratorní nádoby a pomůcky. Liší se účelem, k němuž mají být použity, a přesností. Dodržení teploty je důležité, protože hustota kapaliny se mění s teplotou.
Odměrné nádobí je obvykle kalibrováno při 20 °C (v USA 25 °C). Kalibrační teplota je vyznačena na každé odměrné nádobě.
Pomůcky k odměřování objemu tekutin Pomůcka Obvyklý rozsah objemu Přesnost Erlenmayerova baňka, kádinka 5–5000 ml jen orientační Odměrná baňka 5–2000 ml vysoká Odměrný válec 5–2000 ml střední Byreta 1–100 ml vysoká Pasteurova pipeta, kapátko 1–5 ml malá Skleněná pipeta 1–100 ml vysoká Automatická pipeta 5–5000 μl vysoká Automatický dávkovač 0,1–100 ml střední Mikrostříkačka 0,5–1000 μl vysoká Pístoventilový dávkovač 1–500 ml střední
Kádinky
Používají se k orientačnímu stanovení objemů kapalin. Kromě hrubého odměřování objemů slouží kádinky hlavně k rozpouštění látek, ředění kapalin, zahřívání a dalším laboratorním operacím. Pro nízkou přesnost měření se obvykle mezi odměrné nádoby ani neřadí.
Odměrné baňky a odměrné válce
Odměrné baňky a odměrné válce se kalibrují „na dolití“, což je na nich vyznačeno značkou D podle českého dolít nebo IN podle anglického include. Po doplnění na příslušnou rysku má kapalina uvnitř nádoby přesně uvedený objem. Přelijeme-li kapalinu do jiné nádoby, určité množství zůstane v podobě tenkého filmu či kapek na stěnách, takže přelitím přeneseme menší než vyznačený objem.
Objem se obvykle udává v mililitrech. Při odměřování musí nádoba stát na pevné, vodorovné podložce. Správný objem je odměřen, jestliže se meniskus kapaliny svým dolním okrajem dotýká rysky na nádobě. Odměrné válce slouží pouze k přibližnému odměřování, odměrné baňky slouží k přípravě roztoků o přesné koncentraci.
Byrety, pipety, dávkovače a stříkačky
Byrety, pipety, dávkovače a stříkačky odměřují objem kapaliny odebírané do jiné nádoby.
Pipety a byrety jsou obvykle kalibrované „na vylití“, značka V podle českého vylít nebo Ex podle anglického exclude. Kapalina z nich vyteklá od příslušných rysek má uvedený objem. Obsah pipety nevyfukujeme, i když zůstane ve špičce kapka. S jejím objemem se při kalibraci počítá.
- Byrety
Používají se při titracích, nebo tam, kde se opakovaně odměřuje stejný objem kapaliny. Jedná se o skleněné nebo umělohmotné kalibrované trubice uzavřené kohoutem. Byreta se pomocí držáku upevní svisle ke stojanu. Při uzavřeném kohoutu se opatrně pomocí nálevky naplní příslušnou kapalinou. Nálevka se odstraní a pootevřením kohoutu se vypustí takové množství kapaliny, aby se její dolní meniskus dotýkal rysky. Pak je byreta připravena k titrování. Kohoutem se vypouští titrační činidlo a jeho objem se sleduje na stupnici. K nejdůležitějším úkonům při práci s byretou patří správné odečtení objemu. Na byretě se odečítá vždy dvakrát. Poprvé při určování nulové značky, podruhé při odečítání vypuštěného objemu. Jelikož je odečítána změna objemu, nezáleží příliš na způsobu odečítání. Vždy je však třeba odečítat stejným způsobem.
- V rutinních laboratořích se používají automatické byrety.
- Skleněné pipety
- K měření objemů v moderních rutinních laboratořích se používají již málo a jsou nahrazovány poloautomatickými dávkovači. Objem skleněných pipet může být různý, od 1 do 100 ml. Mohou být buď nedělené, určené k měření jediného objemu, nebo dělené – obvykle po mililitrech a desetinách mililitrů. Stupnice může směřovat od špičky směrem k hornímu okraji nebo naopak.
- Z bezpečnostních důvodů nikdy nenasáváme roztok do pipety ústy – k natažení se používají různé typy nástavců nebo pístů.
- Při nasávání nesmí být pipeta opřena o dno nádoby. Před odměřováním vzorku se pipeta nejprve naplní roztokem a odebraný objem se vypustí do odpadní nádoby. Teprve pak se odebere přesný objem a přenáší do nádoby pro další zpracování. Roztok nesmí nikdy vniknout do pipetovacího nástavce.
- Automatické pipety (pipetory, mikropipety, mikrodávkovače)
- Jednou z možností odměření malých objemů je použití automatických pipet.
Podrobnější informace naleznete na stránce Automatické pipety.
- Mikrostříkačky
- Slouží k přesnému dávkování malých množství (0,1–1000 μl) kapalin. Skládají se z jehly připojené ke skleněnému válci se stupnicí, v němž se pohybuje píst. Jednotlivé typy se liší průměry jehel a pístů.
- Pístoventilové dávkovače
- Jsou tvořeny pístem se stupnicí, který je nasazen na zásobní láhev. Umožňují opakované dávkování určitého objemu kapaliny ze zásobní lahve. Dávkovače určené pro dávkování agresivních chemikálií (např. silných kyselin) mají skleněné části vyrobené z borosilikátového skla, plastové díly, které jsou ve styku s kapalinou jsou vyrobeny z PTFE, ostatní díly jsou z PE nebo PP. V moderních typech dávkovačů je dávkování automatizováno pomocí ovládacích modulů.
Automatické pipety
Podle způsobu ovládání rozlišujeme automatické pipety manuální a elektronické. U manuálních pipet se pístem pohybuje palcem ruky pomocí ovládacího tlačítka. Správnost a přesnost pipetování je výrazně ovlivněna zkušenostmi a zručností pracovníka. V případě elektronických pipet pístem pohybuje elektromotorek. Oproti manuálním nabízí navíc naprogramování způsobu pipetování. Podle povahy kapaliny lze zvolit i různou rychlost pohybu pístu při nasávání a vytlačování kapaliny.
Na tělo pipety (též pipetor) se nasazuje jednorázová špička. Pipetovaná kapalina přichází do kontaktu pouze s touto špičkou.
Automatické pipety lze podle principu jejich práce rozdělit na dva základní typy:
- „Air displacement“ pipety
- Tento typ pipet využívá principu tzv. vzduchového polštáře. Mezi pístem a kapalinou zůstává vždy určitý objem vzduchu. Objem kapaliny nasátý pipetorem do špičky se od objemu vzduchu, nasátého nebo vytlačeného pístem, může mírně lišit v závislosti na hustotě a viskozitě pipetované kapaliny, smáčivosti povrchu špičky pipetovanou kapalinou, teplotě a atmosférickém tlaku a dalších vlivech. Pipetor proto musí být pravidelně kalibrován a seřizován.
- Pipety tohoto typu rozlišujeme dle provedení jako jednokanálové (určené pro pipetování jednoho objemu dané kapaliny v čase) nebo jako vícekanálové (nejčastěji osmi nebo dvanáctikanálové) určené pro současné pipetování stejného objemu dané kapaliny do více jamek v mikrotitrační destičce. Každý kanál u vícekanálových pipet má svůj vlastní píst, proto není nutné využít všech kanálů najednou (je možné připojit méně než 8, resp. 12 špiček).
- Automatické pipety jsou konstruovány buď pro jeden fixní objem nebo jsou nastavitelné na více objemů. Změna nastavení objemu je možná v určitém rozmezí (např. 10–100 μl) pomocí nastavovacího šroubu nebo knoflíku.
- „Positive displacement“ pipetory
- Tento typ pipet nasává kapalinu do špičky přímo bez vytvoření vzduchového polštáře, tj. píst je v přímém kontaktu s odměřovanou kapalinou. Kapalina nasátá do špičky (bez vzduchové bubliny) se vypustí ven najednou (typ stříkačky) nebo po krocích ve stejném objemu (tzv. krokovací pipeta, angl. stepper). Tento typ pipetorů je výhodné používat pro vysoce viskózní nebo těkavé kapaliny, anebo pro opakující se pipetování.
Způsoby použití pipetoru
Přímé pipetování
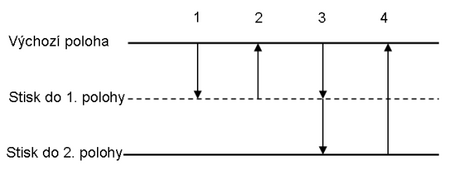
Jde o nejčastěji používanou techniku pipetování. Při přímém pipetování se do špičky nasaje přesně nastavený objem a v dalším kroku se ze špičky kompletně vytlačí do zvolené nádoby. Protože určité množství kapaliny zůstává na vnitřním povrchu špičky jako tenký film, je třeba před pipetováním špičku smočit odměřovanou kapalinou. Přímá technika pipetování se používá pro odměřování většiny vodných roztoků, pufrů, zředěných kyselin a zásad.
Postup
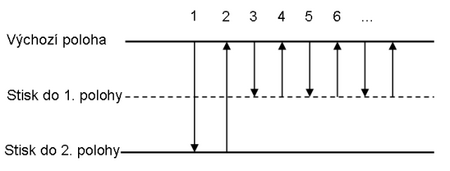
- Nasaďte na dávkovač špičku. Stiskněte tlačítko ovladače do první polohy (nutno překonat malý odpor při stisku tlačítka).
- Ponořte špičku dávkovače asi 2–3 mm pod hladinu roztoku. Pomalu povolujte stisknuté tlačítko ovladače za současného nasátí vzorku do špičky.
- Pomalým nasátím kapaliny do špičky se omezí možný vznik turbulence, která může vyvolat vznik aerosolu a bublinek plynu, vycházejících z kapaliny. Optimální rychlost nasávání závisí na vlastnostech kapaliny (na její hustotě, tenzi par a viskozitě).
- Vždy sledujte, zda do špičky nevnikly bublinky vzduchu (např. při prudším povolení pístu ovladače nebo špatně nasazené špičce).
- Vyšší přesnosti při pipetování dosáhnete, když úplně sundáte palec z tlačítka ovladače, jakmile dosáhne výchozí polohy.
- Pomalu vytáhněte špičku z kapaliny. Při rychlém vytažení se může ztratit část obsahu špičky. Před vytažením špičky z kapaliny počkejte, hlavně u větších pipetorů 500–5000 μl, asi 1–3 vteřiny.
- Při vytlačování kapaliny držte špičku v mírném úhlu proti stěně nádoby (10–45º), těsně nad roztokem, který v ní už je, a plynule stiskněte tlačítko ovladače palcem do první polohy. Vyčkejte asi 1 vteřinu a pokračujte v rychlém stisku tlačítka ovladače až do druhé polohy (pocítíte větší odpor při stisku). Dbejte na to, aby nezůstaly kapičky kapaliny ve špičce nebo nebyly rozstříknuté na stěnách nádoby.
- Podržte tlačítko ovladače zmáčknuté a vytáhněte špičku podél stěny nádobky ven. Nyní povolte tlačítko ovladače.
Při přímém pipetování vzniká určitá chyba tím, že na vnitřní ploše špičky zůstane velmi tenký film přenášené tekutiny. Uvedeným postupem tedy odměříme o něco menší objem, než je nastaveno na pipetě, přičemž chyba závisí především na vlastnostech pipetované kapaliny a materiálu, z nějž je vyrobena špička. Uvedenou chybu lze odstranit tím, že se před pipetováním vnitřní plocha špičky smočí odměřovanou kapalinou. V praxi to znamená, že nejprve výše popsaným postupem nasajeme roztok do špičky, místo jeho odměření do cílové nádoby jej však vrátíme zpět do zásobní nádoby. V tuto chvíli je na vnitřní stěně špičky vytvořen film pipetované kapaliny, v případě bezbarvých roztoků je při správné technice okem neviditelný. Následuje odměření kapaliny přesně podle výše uvedeného postupu (pouze nenasazujeme novou špičku). Jelikož množství kapaliny, které zůstává ve špičce, je prakticky konstantní, odměříme nyní skutečně nastavený objem.
Pokud na vnější stěně špičky zůstanou kapky, je možné je otřít buničitou vatou lehkým pohybem shora dolů. Nikdy se buničinou nedotýkejte ústí špičky, odsáli byste část kapaliny, která je uvnitř.
Reverzní pipetování
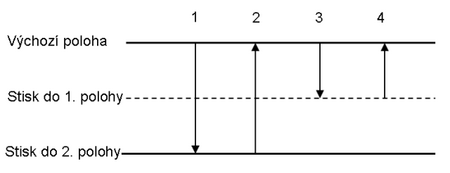
Při reverzním pipetování do špičky nasajeme větší objem kapaliny, než který chceme odměřit, a v dalším kroku vytlačíme ze špičky objem nastavený na pipetě. Tento způsob pipetování poskytuje lepší výsledky při práci s viskózními nebo vysoce těkavými kapalinami, kapalinami silně smáčivými a s roztoky, které pění. Hodí se i pro odměřování velmi malých objemů. Po pipetování zůstane ve špičce vždy zbytek kapaliny, kterou lze vytlačit zpět do zásobní nádoby nebo do odpadu před vlastním odstraněním špičky.
Postup
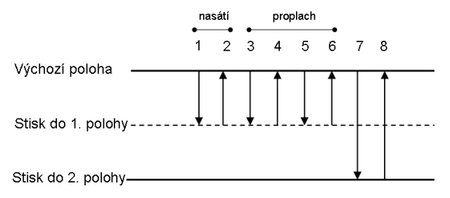
- Stiskněte tlačítko až do druhé polohy (pocítíte nejdříve slabý a poté větší odpor pístu při stisku tlačítka ovladače).
- Ponořte špičku pipety asi 2–5 mm pod hladinu roztoku. Pomalu povolujte píst za současného nasátí vzorku do špičky.
- Pomalu vytáhněte špičku z kapaliny a odstraňte kapky ulpělé na vnější stěně špičky dotekem špičky o okraj nádoby.
- Při vytlačování daného objemu kapaliny držte špičku v mírném úhlu proti stěně nádoby těsně nad roztokem, který v ní již je, a pomalu plynule stiskněte palcem tlačítko ovladače do první polohy.
- Držte tlačítko ovladače zmáčknuté v této poloze a vytáhněte špičku z nádoby ven.
- Část kapaliny, která zůstane ve špičce, vytlačte stiskem tlačítka ovladače do druhé polohy zpět do původní nádoby nebo do odpadu.
- Podržte tlačítko ovladače zmáčknuté a vytáhněte špičku z kapaliny ven a pak povolte tlačítko ovladače.
Opakované pipetování
Tento způsob pipetování je určen pro opakované pipetování stejného objemu, např. pro přidávání činidla do série zkumavek nebo do jamek v mikrotitrační destičce. Jedná se vlastně o opakující se reverzní pipetování. Po nasátí kapaliny do špičky se opakují kroky 2 až 4.
Pipetování heterogenních vzorků
Technika vhodná pro pipetování heterogenních vzorků jako je krev, kdy není snadný proplach špičky před pipetováním. Podobá se přímé technice, ale špička se předem nesmáčí odměřovanou kapalinou. Namísto toho se po přenesení kapaliny opakovaně propláchne roztokem, s nímž se odměřovaná kapalina mísí.
Postup
- Stiskněte tlačítko do první polohy a ponořte špičku dávkovače asi 2–5 mm pod hladinu roztoku.
- Pomalu povolujte píst za současného nasávání vzorku do špičky.
- Pomalu vytáhněte špičku z kapaliny a odstraňte kapky roztoku ulpělé na vnější stěně špičky vytažením špičky podél stěny nádoby.
- Ponořte špičku dávkovače do cílového roztoku.
- Stiskněte ovládací tlačítko do první polohy a pak ho pomalu povolte do původní polohy. Tím dojde k nasátí roztoku do špičky. Špičku nevyndávejte z roztoku a opakujte tento krok, dokud vnitřní stěna špičky není čistá.
- Po stěně povytáhněte špičku nad hladinu roztoku a vyprázdněte ji stiskem tlačítka ovladače do druhé polohy.
- Podržte tlačítko ovladače zmáčknuté a vytáhněte špičku z nádoby podél stěny ven a pak povolte tlačítko ovladače.
Filtrace
Filtrace se používá k rozdělení směsi na základě velikosti částic. Filtrovaná směs se nalije na filtr z vhodného porézního materiálu. Částice, které jsou menší než póry, filtrem procházejí a dostávají se do filtrátu, zatímco větší částice zůstanou na povrchu filtru a vytvoří tzv. filtrační koláč.
Filtr
Filtr může být vyroben z nejrůznějších materiálů. Mezi nejdéle používané patří filtrační papíry – speciální neklížené papíry s vhodnou porozitou. K odfiltrování hrubších částic lze také použít mul, vatu, minerální („skelnou“) vatu apod. Naopak pro oddělení menších částeček se používají filtrační membrány vyrobené např. z acetátu celulózy, PVDF, nylonu a dalších materiálů.
Uspořádání filtrace
Filtrace roztoků přes membrány s velmi jemnými póry by často byla časově značně náročná. Lze ji urychlit např. zvýšením tlaku filtrované kapaliny (přetlaková filtrace) nebo naopak odsáváním filtrátu (podtlaková filtrace).
Nejjednoduším příkladem přetlakové filtrace může být použití stříkačkových filtrů – filtrovaná směs se nasaje do stříkačky, k níž se připojí filtrační membrána uzavřená v pouzdře. Tlakem na píst stříkačky vzniká přetlak.
Na obdobném principu pracují také centrifugační filtry. V tomto případě připomíná složená filtrační jednotka zkumavku nebo mikrozkumavku. Po naplnění části pro filtrovanou směs se vloží do centrifugy, filtrace je urychlena díky odstředivým silám.
Podtlaková filtrace je naproti tomu založena na odsávání filtrátu. V klasickém uspořádání se filtrační membrána pokládá na Büchnerovu nálevku, která je připojena přes odsávací baňku k vakuu. Komerčně jsou dnes dostupné jednorázové filtrační jednotky pro podtlakovou filtraci vyrobené z vhodného plastu.

|

|

|
| Stříkačkový filtr | Centrifugační filtr (obrázek z [2]) | Vakuová filtrace (obrázek z [3]) |
Filtrace přes papírový filtr
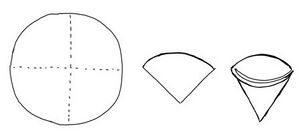
- Kolečko filtračního papíru se poskládá na čtvrtiny. Pak se rozloží tak, aby vznikl kalíšek.
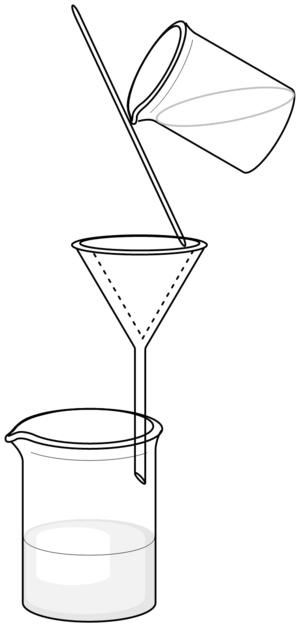
- Složený filtr se vloží do nálevky. Často je vhodné jej zvlhčit (obvykle destilovanou vodou).
- Během filtrace by se konec stopky nálevky měl dotýkat stěny sběrné nádoby. Filtrovaná směs se lije na trojitou vrstvu filtračního papíru.
- Filtrovanou směs je třeba dolévat pozvolna. Nikdy by neměla dosáhnout k okraji filtru, aby jej nepřetekla.
Centrifugace
Centrifugace [4][5][6] slouží k rozdělení částic pomocí odstředivé síly. Často jde o urychlení sedimentace. Zatímco při sedimentaci se částice rozdělují podle své hustoty vlivem gravitačního zrychlení, při centrifugaci na ně působí mnohem větší odstředivé zrychlení. Rozdělení směsi proto probíhá mnohem rychleji.
V nejjednodušších případech se centrifugace používá k oddělení pevných částic ze suspenze, např. k odstranění sraženin či krvinek z plné krve. Pomocí centrifugace je také možné rozdělit směsi nemísitelných kapalin. S využitím vysokých rychlostí, jichž se dosahuje ve vysokootáčkových centrifugách a ultracentrifugách, lze také separovat jednotlivé součásti buněk z buněčného lyzátu nebo rozdělit směsi makromolekul.
Centrifugační zrychlení
Lze nahlédnout, že rozdělení směsi při centrifugaci bude probíhat tím rychleji, čím rychleji se bude točit rotor centrifugy. V praxi se většinou pracuje s veličinou označovanou jako relativní centrifugační síla (relative centrifugal force, RCF). Udává, kolikrát je odstředivé zrychlení vyšší než tíhové zrychlení (g) a zpravidla se uvádí v násobcích g.
Snadno lze odvodit, že relativní centrifugační síla závisí na poloměru rotoru centrifugy a počtu otáček:
- RCF = 1,12 · n2 · r · 10−5
kde RCF je relativní centrifugační síla, n je počet otáček rotoru za minutu a r je poloměr rotoru v centimetrech.
Rychlost, kterou se budou jednotlivé částice ve směsi během centrifugace pohybovat, se uvádí jako tzv. sedimentační rychlost. Za idealizovaných podmínek je úměrná odstředivému zrychlení (tedy relativní centrifugační síle) a rozdílu hustoty částice a prostředí, v němž je dispergována. Dále závisí na velikosti částice a viskozitě směsi.
Namísto sedimentační rychlosti se často pracuje se sedimentačním koeficientem – veličinou, která popisuje chování konkrétní částice bez ohledu na podmínky centrifugace. Sedimentační koeficient vlastně odpovídá sedimentační rychlosti v poli o jednotkovém zrychlení (tj. asi 10× menším, než je tíhové zrychlení). Udává se v sekundách, popřípadě se používá násobná jednotka Svedberg (1 Svedberg = 1 S = 10−13 s).
V literatuře se můžeme setkat s údajem, že podjednotky ribosomu mají „velikost“ 30 S a 50 S. Je tak vlastně popsáno jejich chování při ultracentrifugaci buněčných frakcí. Velmi zhruba lze říci, že pokud bychom nechali sedimentovat např. podjednotku 30 S ve volně stojící zkumavce, tj. při tíhovém zrychlení asi 10 ms−2, klesala by rychlostí
- 30 · 10−13 s · 10 ms−2 = 3·10−11 ms−1, což je necelý milimetr za rok.
Ve skutečnosti by nesedimentovaly vůbec, neboť proti sedimentaci by působila difuze. Je zjevné, že pro oddělení podjednotek ribozomů je potřeba dosáhnout zrychlení většího o několik řádů.
Centrifugy
Pokud pro zpracování materiálu postačují malé relativní centrifugační síly (do 20 000× g či ještě méně), lze použít poměrně jednoduché nízkoobrátkové centrifugy. Pro sedimentaci velmi malých částic se používají ultracentrifugy, jejichž rotor pracuje ve vakuu, čímž se zamezí jeho brždění vzduchem a zahřívání. Součásti ultracentrifug musejí odolávat obrovským silám a jsou proto velmi náročné na výrobu; cena ultracentrifug je proto vysoká.
Mezi nízkootáčkovými centrifugami a ultracentrifugami stojí tzv. vysokootáčkové centrifugy. Pracují bez vakua, lze však pomocí nich dosáhnout zrychlení až kolem 100 000× g.
Centrifugování při vyšších otáčkách by kvůli tření o vzduch vedlo k zahřívání vzorku, navíc biologické vzorky často musí být zpracovávány při nízkých teplotách. Centrifugy proto bývají často vybaveny chlazením.
Praktické poznámky
Centrifugované vzorky je do rotoru potřebné vkládat tak, aby byl rotor vyvážen. Odstředivé síly, kterými jednotlivé vzorky působí na hřídel rotoru, se musí vzájemně vyrušit. V praxi to znamená, že je třeba vzorky do rotoru vkládat tak, aby v protilehlých pozicích byly vždy dvě stejně těžké zkumavky. Čím větší rychlost otáčení se použije, tím přesněji musí být rotor vyvážen. Při nízkých otáčkách postačí použít pro všechny vzorky zkumavky stejného typu a napipetovat do nich stejné objemy vzorků. Při ultracentrifugaci se zkumavky váží a objem vzorku se upravuje tak, aby protilehlé zkumavky měly přesně stejnou hmotnost.
Odkazy
Reference
- ↑ ČMELÍK, Milan, Lubor MACHONSKÝ a Zdislav ŠÍMA. Fyzikální tabulky. 2. vydání. Liberec : Technická univerzita v Liberci, 2005. 60 s. ISBN 80-7372-009-4.
- ↑ VWR. Filtry centrifugační [online]. [cit. 2016-10-06]. <https://cz.vwr.com/store/product/553721/filtry-centrifugacni>.
- ↑ Merck. Pyrex® Vacuum filtration system for 47 mm membranes [online]. [cit. 2018-06-20]. <https://www.sigmaaldrich.com/catalog/product/aldrich/slw5809kit?lang=en®ion=US>.
- ↑ KODÍČEK, Milan. Biochemické pojmy. Výkladový slovník [online]. VŠCHT Praha, ©2007. [cit. 2009-10-28]. <http://147.33.74.135/knihy/uid_es-002/ebook.html>.
- ↑ LABÍK, Stanislav, Michal BUREŠ a Pavel CHUCHVALEC, et al. Příklady z fyzikální chemie online. Disperzní systémy. [online]. ©2008. Poslední revize 2008-12-10, [cit. 2009-10-28]. <http://old.vscht.cz/fch/prikladnik/prikladnik/p.html>.
- ↑ VÁVROVÁ, Jaroslava. Datový standard MZ ČR. Odstřeďování (centrifugace) [online]. ©2009. [cit. 2009-10-28]. <http://ciselniky.dasta.mzcr.cz/CD_DS4/hypertext/JVACO.htm>.