Entalpie
Entalpie (zastarale „tepelný obsah“) je veličina vyjadřující tepelnou energii uloženou v dané látce. Jedná se o stavovou funkci termodynamické soustavy. Je určená vztahem pro soustavu s neměnným počtem částic, s vnitřní energií , tlakem a s objemem soustavy . Matematicky je definována:
Motivace[upravit | editovat zdroj]
Vychází z 1. termodynamického zákona: systém může konat práci jen tehdy, poklesne-li jeho vnitřní energie nebo je-li mu dodáno teplo :
V této znaménkové konvenci je práce kladná, koná-li ji systém na okolí (např. expanze plynu).
Zvyšuje-li systém svůj objem proti vnějšímu tlaku , koná při tom mechanickou práci:
Vzhledem k předchozí rovnici můžeme psát, že:
Proto byla definována funkce (entalpie, tepelný obsah):
Jednotkou entalpie v systému SI je joule (J).
Je možné také zavést měrnou entalpii vztahem:
kde značí hmotnost. Jednotkou měrné entalpie je poté v systému SI joule na kilogram látky (J·kg-1).
Vztah k vnitřní energii[upravit | editovat zdroj]
Vnitřní energie je vhodná pro vyjadřováni energetických změn dějů probíhajících za stálého objemu. Entalpie se s výhodou používá pro výpočet energetických změn za stálého tlaku. Jelikož většina chemických procesů probíhá za stálého tlaku, je entalpie v chemické termodynamice častěji používanou veličinou než vnitřní energie.
Pakliže bychom znali hodnoty entalpií reagujících složek v chemické reakci, byl by výpočet jednoduchý. Problém však nastává v tom, že nedovedeme určit absolutní hodnoty entalpií. Vždy se totiž zjišťuje jen změna této funkce, ke které dochází, když látka přechází z jednoho stavu do druhého (z výchozího do konečného). Proto se zavádí v chemické termodynamice stupnice relativních hodnot entalpií. Nulová hodnota entalpie je entalpie prvků v základním stavu, v jejich stabilní formě – při tlaku 101,325 kPa a při teplotě 298,15 K (25 °C). Pouze v tomto stavu lze jejich entalpie změřit.
Význam entalpie[upravit | editovat zdroj]
Zavedením entalpie se značně zjednoduší termodynamické vztahy pro izobarické děje. Jestliže soustava přijímá teplo a koná objemovou práci, bude rovnice pro výpočet změny vnitřní energie:
v diferenciálním tvaru:
Jde-li o práci reverzibilní, pak označuje tlak soustavy. Je-li tento tlak konstantní (při izobarickém ději), můžeme rovnici napsat ve tvaru:
Pro izobarický děj tedy platí, že teplo přijaté soustavou se rovná zvýšení entalpie soustavy.
Její význam je také při posuzování procesů v tepelných strojích, ve kterých je látka přiváděna a odváděna při stálém tlaku. Jestliže látka koná ve stroji při expanzi práci bez přívodu a odvodu tepla, je tato práce při jednom cyklu úměrná rozdílu entalpie látky (počáteční a konečný stav).
Reakční teplo[upravit | editovat zdroj]
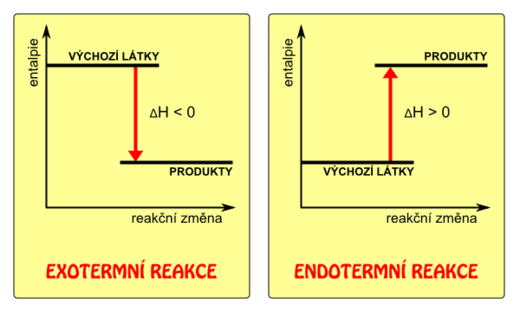
Reakční teplo je množství tepla, které soustava s okolím vymění při reakci. Reakce probíhá za konstantního tlaku v rozsahu 1 molu základních reakčních přeměn. Jak již víme, při izobarických dějích vyjadřuje výměnu tepla mezi soustavou a okolím právě entalpie.
značí entalpii na začátku (reaktanty), značí entalpii na konci (produkty).
- Jedná se o endotermickou reakci, soustava přijímá teplo z okolí.
- Jedná se o exotermickou reakci, soustava odevzdává teplo do okolí.
Grafické vyjádření:
Rozdělení[upravit | editovat zdroj]
Reakční teplo můžeme rozdělit dle toho, zda při reakci vznikne z prvků sloučenina, nebo zdali se sloučenina spálí v nadbytku kyslíku. Výpočet reakčních tepel je možný díky 2. termodynamickému zákonu.
Standardní slučovací teplo[upravit | editovat zdroj]
[ kJ.mol-1]. Je reakčním teplem reakce, při kterém vznikne 1 mol sloučeniny z prvků. Podmínkou vzniku je standardní stav prvků i produktů, to je teplota 298,15 K, tlak 101,325 kPa. Standardní slučovací tepla prvků jsou vždy nulová.
Standardní spalné teplo[upravit | editovat zdroj]
[kJ.mol−1]. Je reakčním teplem reakce, při kterém je 1 mol látky spálen. Opět platí, že prvky a produkty musí být ve standardním stavu. Spalná tepla prvků jsou nenulová.
Odkazy[upravit | editovat zdroj]
Související články[upravit | editovat zdroj]
Externí odkazy[upravit | editovat zdroj]
Zdroj[upravit | editovat zdroj]
- KUBATOVA, Senta. Biofot [online]. [cit. 2011-01-31]. <https://uloz.to/!CM6zAi6z/biofot-doc>.
- MECHLOVÁ, Erika a Karel KOŠŤÁL. Výkladový slovník fyziky. 1. vydání. Praha : Prometheus, 1999. 588 s. ISBN 80-719-6151-5.
- FISHER, Oldřich, et al. Fyzikální chemie. 1. vydání. Praha : SPN, 1984.
- ČELEDA, Jiří, et al. Kurs základů chemie. 1. vydání. Praha : SPN, 1968.
- MAREČEK, Aleš a Jaroslav HONZA. Chemie pro čtyřletá gymnázia. 1. díl. 3. vydání. Brno : Aleš Mareček, 2013. ISBN 80-7182-055-5.