Modely atomu
Modely atomu[upravit | editovat zdroj]
V historii jaderné fyziky bylo navrženo mnoho různých modelů atomu. Většina vznikla v období od začátku 19. století do první poloviny 20. století, kdy byl navržen model, který je používán i dnes (nebo alespoň přijímán jako nejpřesnější. Povědomí o existenci atomu je však mnohem starší, již antičtí Řekové měli svou koncepci atomu. Tento článek je však zaměřen hlavně na pět modelů atomu, které přispěly k dnešnímu pojetí jeho struktury – Daltonův model, Thomsonův „pudinkový“ model, Rutherfordův planetární model, Bohrův model a kvantově mechanický model/model elektronového mraku.
Atomismus[upravit | editovat zdroj]
Za první model atomu lze považovat atomismus. Atomismus je filozofický směr pocházející z antického Řecka. Tento směr tvrdí, že vesmír je složen z malých, dále nedělitelných částic. Jeho nejznámějšími představiteli byli filozofové Leukippos a Demokritos. Atomismus byl využit v pozdějších modelech atomu.
Daltonův model atomu[upravit | editovat zdroj]
John Dalton byl anglický vědec, který přišel s názorem, že všechna hmota je složena z velmi malých částeček. Jeho model byl prvním uceleným pokusem popsat veškerou hmotu skrz koncept částic. Tyto částice nazval atomy. Jeho model říká, že:
- Všechna hmota je tvořena atomy. Atomy jsou neviditelné a nedělitelné.
- Všechny atomy daného prvku mají stejnou hmotnost a vlastnosti.
- Sloučeniny jsou tvořeny kombinací dvou a více různých atomů.
- Chemická reakce je přeskupení atomů.
Části jeho teorie musely být upraveny kvůli objevu subatomárních částic a izotopů. Dnes víme, že atomy nejsou nedělitelné, protože jsou tvořeny neutrony, elektrony a protony.
Thomsonův "pudinkový" model atomu[upravit | editovat zdroj]
Po objevu elektronu v roce 1897 bylo jasné, že atomy jsou tvořeny z menších částic. O pár let později (roku 1904) navrhnul J. J. Thomson svůj slavný „pudinkový“ model atomu. Bylo známo, že atomy obsahují záporně nabité elektrony, ale atomové jádro ještě objeveno nebylo. Thomson věděl, že atomy nemají kladný ani záporný náboj, a že tedy musí existovat něco, co vyváží záporný náboj elektronů. V jeho modelu se záporně nabité částice pohybují v prostředí s rovnoměrně rozloženým kladným nábojem. Tento model je nazýván pudinkový, neboť elektrony připomínají hrozinky v pudinku.
Rutherfordův model atomu[upravit | editovat zdroj]
Rutherford jako první upozornil, že Thomsonův model není správný. V jeho novém modelu už bylo přítomno i atomové jádro. Atomové jádro obsahuje relativně velký náboj soustředěný do malého objemu, ve kterém se nachází také většina hmotnosti atomu. Jádro je pak obklopeno lehčími, záporně nabitými elektrony. Tento model je někdy nazýván planetární model atomu. Ani tento model však nebyl bez chyb. Rutherford například nedokázal vysvětlit, proč atomy vyzařují fotony pouze o určitých energiích. Tento problém později vyřešil dánský fyzik Niels Henrik David Bohr.
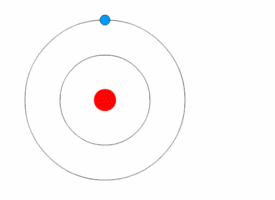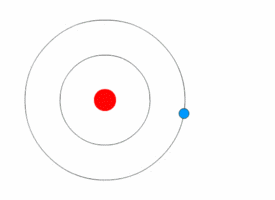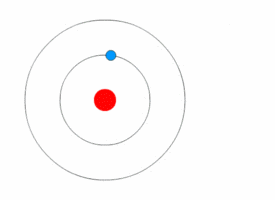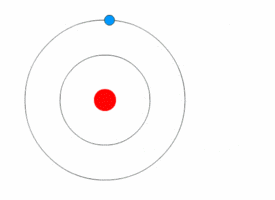
Bohrův model atomu[upravit | editovat zdroj]
Bohrův model popisuje atom jako kladně nabité jádro obklopené záporně nabitými elektrony. Elektrony se pohybují po kruhových drahách okolo jádra a jsou přitahovány elektrostatickými silami. Elektrony se mohou pohybovat v několika energetických hladinách. Atomy se běžně vyskytují v základním stavu. Při absorpci energie se elektron může posunout do méně stabilní hladiny s vyšší energií, čímž se atom dostane do excitovaného stavu. Uvolněním energie se elektron může opět vrátit do původního stavu. Obecně, kdykoliv se elektron pohybuje mezi energetickými hladinami, je jeho přesun doprovázen absorpcí nebo uvolněním energie.
Kvantově mechanický model/model elektronového mraku[upravit | editovat zdroj]
Kvantově mechanický model je dnes přijímán jako nejrealističtější model popisující atom tak, jak ho vnímá současná věda. Je výsledkem kombinace několika vědeckých předpokladů:
- Všem částicím přísluší vlnová funkce. (Louis de Broglie)
- Na základě předchozího předpokladu byl navržen model atomu, který uvažuje o elektronu jako o částici i o vlně. (Erwin Schrödinger, kvantově mechanický model vznikl z řešení Schrödingerovy rovnice)
- Princip neurčitosti říká, že nemůžeme znát jak přesnou energii, tak pozici elektronu. Z toho vyplývá, že čím přesněji známe pozici elektronu, tím méně víme o jeho energii a naopak. (Werner Heisenberg) Tato neurčitost vyvolala četné filozofické debaty a pokusy o popis fyzikální reality v mikrosvětě, které vyústily mimo jiné v tzv. Kodaňskou interpretaci kvantové mechaniky. Bylo to právě v reakci na ní, kdy Schrödinger poprvé zformuloval svůj pověstný myšlenkový experiment s kočkou, kterým ilustroval suprapozici radioaktivního nuklidu.
- V atomu existuje více než jedna energetická hladina. Elektronům jsou přiřazeny orbitaly, které se vzájemně energeticky liší. (Niels Bohr)
- Elektrony mají vlastnost nazývanou spin. Každý elektron může mít jednu ze dvou možných hodnot spinu – spin-up nebo spin-down. Dva elektrony okupující stejný orbital musí mít vždy opačný spin. (Sternův-Gerlachův experiment)
Základní popis kvantově mechanického modelu[upravit | editovat zdroj]
Kvantově mechanický model říká, že elektrony se nepohybují okolo jádra na přesně určených drahách (jak říká př. Rutherfordův model), ale v určitém trojrozměrném prostoru – orbitalu. V daném orbitalu jsou přítomny jen s určitou pravděpodobností, jejich pozice nemůže být určena se 100% přesností. K popisu elektronů a jejich orbitalů byla zavedena čtyři kvantová čísla.
Kvantová čísla[upravit | editovat zdroj]
Hlavní kvantové číslo: n[upravit | editovat zdroj]
- určuje velikost orbitalu a energii elektronů v orbitalu
- přirozená čísla – 1, 2, 3, 4,... (teoreticky až donekonečna, prakticky se popisuje 7 energetických hladin); někdy se čísla nahrazují velkými písmeny od K (K=1, L=2 atd.)
- popisuje velikost orbitalu
Vedlejší kvantové číslo: l[upravit | editovat zdroj]
- určuje tvar orbitalu
- jeho hodnota je určena hodnotou hlavního kvantového čísla n, nabývá hodnot od 0 do n-1 (př. orbitaly s hlavním kvantovým číslem n=2 mohou mít dva tvary – l=0 a l=1)
- každá hodnota l má přiřazeno písmeno, které popisuje tvar orbitalu (0=s, 1=p, 2=d, 3=f)
Magnetické kvantové číslo: m[upravit | editovat zdroj]
- určuje orientaci různých tvarů orbitalu v prostoru
- nabývá hodnot od -l přes nulu do +l (př. pro orbital, kde platí l=2 existuje pět možností, jak ho zorientovat v prostoru – m=-2, -1, 0, 1, 2)
Spinové kvantové číslo: s[upravit | editovat zdroj]
- popisuje směr, v jakém elektron rotuje v magnetickém poli – po směru nebo proti směru hodinových ručiček, tudíž jsou jen dvě možné hodnoty – s=-1/2 a s=+1/2
- v daném orbitalu se mohou nacházet jen dva elektrony, které mají opačný spin – podle Pauliho principu výlučnosti
Pravidla zaplňování orbitalů[upravit | editovat zdroj]
Na základě znalosti kvantových čísel můžeme sestavit elektronovou konfiguraci, která odpovídá rozložení elektronů v atomu. Platí následující pravidla:
Pauliho princip výlučnosti
- v jednom atomu se nemohou nacházet dva elektrony, které by měly všechna čtyři kvantová čísla stejná, vždy se musí lišit alespoň jedním
Výstavbový princip
- orbitaly se zaplňují postupně od orbitalů s nejnižší energií
- energie orbitalu je určena součtem n+l (hlavní a vedlejší kvantové číslo)
- př. 1s má hodnotu 1+0, 2s má hodnotu 2+0. 1s má nižší energii a tudíž se zaplní jako první
- pokud mají dva orbitaly stejný součet n+l (př. 3s a 2p), jako první se zaplní orbital s nižším hlavním kvantovým číslem (v tomto případě 2p)
Hundovo pravidlo
- v degenerovaných orbitalech (takových orbitalech, které mají stejné hlavní a vedlejší kvantové číslo a liší se pouze magnetickým kvantovým číslem) se každý orbital napřed zaplní jedním elektronem se stejným hlavním a vedlejším kvantovým číslem, teprve poté se párují elektrony s opačným spinem
Kvantově mechanický model je významný ze dvou důvodů. Zaprvé nám možnost vybudovat elektronovou strukturu umožňuje pochopit, jak atomy interagují ve sloučeninách a tím nám přiblížit vlastnosti těchto sloučenin, zadruhé ponechává otevřené dveře dalším potenciálním teoriím, které rozšíří naše povědomí o světě a vesmíru kolem nás.
Zdroje[upravit | editovat zdroj]
- Tento článek je překladem následujícího anglického článku: https://www.wikilectures.eu/w/Atomic_Models
- Leoš Navrátil, Jozef Rosina a kolektiv, Medicínská biofyzika, 2019, Praha, Grada, ISBN: 80-247-11524
- Thomsonův model atomu: převzato 4.12.2019 z https://en.wikipedia.org/wiki/Plum_pudding_model
- Bohrův model atomu: převzato 4.12.2019 z https://en.wikipedia.org/wiki/Atom
- Tvary orbitalů a jejich orientace pro různé kombinace vedlejších a magnetických kvantových čísel: MEFANET, síť lékařských fakult ČR a SR. (n.d.). Orbital. Převzato 3.12.2019 z http://www.wikiskripta.eu/w/Orbital#/media/File:Single_electron_orbitals.jpg
- Ilustrace výstavbového principu: převzato 4.12.2019 z https://en.wikipedia.org/wiki/Atom
- Hundovo pravidlo: převzato 4.12.2019 z https://en.m.wikibooks.org/wiki/High_School_Chemistry/Orbital_Configurations