Schrödingerova rovnice
Schrödingerova rovnice je matematická rovnice popisující kvantový systém, např. elektron v atomu.
V klasickém (makroskopickém) světě používáme pro popis pohybu těles klasickou mechaniku, založenou na Newtonových zákonech. Při popisu mikroskopického světa je však nutno použít kvantovou mechaniku. Schrödingerova rovnice má v kvantové mechanice obdobnou roli jako druhý Newtonův zákon v klasické mechanice. Řešením Schrödingerovy rovnice je vlnová funkce (wave function) ,[pozn. 1] která plně charakterizuje kvantový systém.
V některých případech (např. při zkoumání stavby atomů) nás nezajímá časový vývoj systému, jen jeho stacionární stav. Pak používáme tzv. stacionární (časově nezávislou, bezčasovou) Schrödingerovu rovnici (time-independent Schrödinger equation), která má tvar:[pozn. 2]
kde je Hamiltonův operátor, [pozn. 3] který vyjadřuje celkovou energii systému. Číslo je energie daného stavu.
Schrödingerova rovnice je nerelativistická, tedy uvažuje rychlost částic mnohem menší než rychlost světla ve vakuu (a všechno, co z toho plyne).
Význam vlnové funkce[upravit | editovat zdroj]
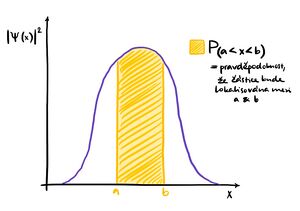
V mikroskopickém světě není možné částici přesně lokalizovat v prostoru, neboť platí Heisenbergovy relace neurčitosti. Lze u ní určit jenom pravděpodobnost , že bude v nějaké části prostoru. Vlnová funkce udává právě tuto pravděpodobnost. Například pravděpodobnost, že částice v jednorozměrném prostoru bude lokalizovaná mezi body a je dána
Geometricky tedy plocha pod křivkou odpovídá pravděpodobnosti výskytu částice (viz obrázek). Vlnová funkce je obecně komplexní funkce.[pozn. 4]
Vlnová funkce elektronu v atomu (v molekule) se nazývá atomový (molekulový) orbital.
Odkazy[upravit | editovat zdroj]
Poznámky pod čarou[upravit | editovat zdroj]
- ↑ Pro vlnovou funkci (vlnový vektor) se používa často Diracův zápis
- ↑ Aneb
- ↑ Pro jednoduchost můžeme o operátoru uvažovat jako o matici. Na levé straně pak působí matice na vektor , na pravé je tento vektor násoben reálním číslem . Vlnovou funkci není možno pokrátit a psát . Jedná se totiž o zcela odlišné matematické objekty (operátor - matice vs. číslo).
- ↑ Proto v integrálu píšeme absolutní hodnotu. Platí kde značí funkci komplexně zdrženou k .