Odběr žilní krve
Periferní žilní krev dospělých se nejčastěji odebírá pomocí uzavřených odběrových systémů, které chrání odebírajícího pracovníka před kontaminací krví pacienta a současně chrání odebíraný biologický materiál před kontaminací zvenčí. Používají se především vakuované odběrové zkumavky. Jednorázová odběrová zkumavka již obsahuje preparační činidla (např. protisrážlivé látky, nebo naopak akcelerátory koagulace). Je hermeticky uzavřená a je v ní vytvořené vakuum, které při odběru zajistí nasátí správného množství krve. Tím je zajištěn i správný poměr krve a preparačních činidel.
Odběrové zkumavky a materiál připravovaný z žilní krve[upravit | editovat zdroj]
Sérum[upravit | editovat zdroj]
Krevní sérum je základní materiál pro většinu rutinních klinicko-biochemických stanovení. Z odebrané plné žilní krve se připravuje jejím vysrážením a centrifugací. Tím se materiál zbaví krevních elementů, fibrinogenu a většiny dalších koagulačních faktorů. Vysrážením fibrinu se v séru oproti plazmě snižuje celková koncentrace bílkovin asi o 4 g/l. Mírně se snižuje také koncentrace vápníku, který se při koagulaci spotřebovává.
Výhodou séra je dobrá stabilita většiny analytů (při skladování v chladu obvykle hodiny až dny), mnohdy je dokonce možné vzorek zmrazit a dlouhodobě uložit. Nevýhodou je delší příprava materiálu, koagulace a centrifugace trvá kolem 45 minut.
Krev pro získání séra lze odebrat do zkumavky bez jakýchkoli činidel, ke koagulaci dojde po kontaktu se sklem. Srážení ale trvá poměrně dlouho, pro spolehlivé výsledky je třeba před centrifugací čekat alespoň 60 minut. Tím se zvyšuje riziko hemolýzy a uvolnění intracelulárních součástí z krevních elementů. Současně může po nějakou dobu pokračovat metabolismus v krevních buňkách, což rovněž ovlivňuje koncentraci některých látek. Proto se používají převážně zkumavky, do kterých jsou přidané aktivátory koagulace – např. různé formy oxidu křemičitého. Přídavek aktivátoru zkracuje čas potřebný pro spolehlivé vysrážení koagula na 30 minut.
Pro snazší oddělení séra může být v odběrové zkumavce separační gel. Při centrifugaci sedimentují krevní elementy a koagulum pod gel, sérum zůstává nad ním. Gel usnadní separaci séra a současně brání kontaminaci séra intracelulárním obsahem krevních elementů, který se postupně uvolňuje. Separační gel bývá tvořen nejčastěji akrylátovými polymery s přídavkem oxidu křemičitého, který dále urychluje koagulaci.
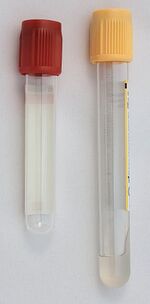
Odběrové zkumavky pro přípravu krevního séra mají obvykle zlatožlutou (se separačním gelem) nebo červenou (bez gelu) zátku.
Plazma a heparinizovaná plná krev[upravit | editovat zdroj]
Základním materiálem pro většinu statimových biochemických vyšetření je krevní plazma. Jako antikoagulační činidlo se k její přípravě používá heparinát lithný (lithium heparin). Příprava plazmy je rychlejší než příprava séra, neboť odpadá čas potřebný pro sražení krve. Zkumavky mají vysušeným heparinem potažené stěny. Po odběru se s ním krev promísí opakovaným otočením zkumavky a hned poté lze zahájit centrifugaci. Zkumavky pro přípravu plazmy mohou také obsahovat gel, který usnadní separaci plazmy od krevních elementů.
Přídavek heparinu poměrně málo ovlivňuje běžná biochemická stanovení. Nejčastěji se používá lithná sůl heparinu, neboť na rozdíl od heparinátu sodného nebo draselného nemění koncentraci sodíku či draslíku, tedy základních a běžně stanovovaných iontů.
Heparin se jako antikoagulační činidlo může použít i pro některá vyšetření z plné krve, např. vyšetření acidobazické rovnováhy a krevních plynů. V tom případě se používají heparinizované kapiláry nebo speciální odběrové soupravy se stříkačkou pro anaerobní odběr. Heparinizovaná krev se však nehodí pro hematologická vyšetření (heparin interferuje s barvením krevních nátěrů) ani pro molekulárně-biologické metody (inhibuje polymerázy používané při PCR).
Vakuované zkumavky s heparinem jsou obvykle značené zeleně – světle zelenou zátku mají zkumavky se separačním gelem, tmavě zelenou bez gelu.
Plná krev s EDTA[upravit | editovat zdroj]
Pro vyšetření krevních elementů (krevní obraz) se používá nesrážlivá plná krev, pro jejíž přípravu slouží jako antikoagulační činidlo některá ze solí etylendiaminotetraoctové kyseliny (EDTA). Nejčastěji se používají dobře rozpustné draselné soli, K2-EDTA a K3-EDTA. Plná krev s EDTA je vhodná také pro vyšetření většiny analytů, které jsou intracelulárně v krevních buňkách, např. glykovaného hemoglobinu, a pro analýzu DNA a molekulárně-biologické metody.
Krev s přídavkem EDTA není vhodná pro mnoho ostatních biochemických metod. Výrazně se mění koncentrace iontů a dochází k inhibici řady enzymů. EDTA také nelze použít pro vyšetření krevní srážlivosti, přestože mechanismus jejího antikoagulačního účinku spočívá v chelaci vápenatých iontů, podobně jako účinek citrátu. Působení EDTA však nelze zcela zrušit rekalcifikací plazmy, pravděpodobně proto, že EDTA vychytává i další kovy (např. měď), které jsou nutné pro funkci některých koagulačních faktorů (např. f. V a VIII).
Zkumavky s přídavkem solí EDTA jsou nejčastěji značené fialovou (levandulovou) zátkou.
Citrátová plazma a plná krev s citrátem[upravit | editovat zdroj]
Vyšetření koagulačních parametrů se provádí z plazmy dekalcifikované citrátem. Používají se především pufrované roztoky citronanu sodného. Plná krev s citrátem, případně s dalšími aditivy (teofylinem, adenosinem a dipyridamolem) se používá pro stanovení destičkových funkcí. Citrát se jako antikoagulans používá také při měření rychlosti sedimentace erytrocytů.
Citrát mění koncentraci iontů a inhibuje některé enzymy. Citrátová plazma proto není vhodná pro většinu biochemických stanovení.
Zkumavky s přídavkem citrátu se značí světle modrou zátkou, speciální zkumavky pro sedimentaci erytrocytů mají zátku černou.
Plazma, sérum a plná krev s inhibitorem glykolýzy[upravit | editovat zdroj]
Krevní buňky i po odběru krve spotřebovávají glukózu. Koncentrace glukózy tak v průběhu zpracování vzorku postupně klesá, v závislosti na teplotě a dalších faktorech asi o 0,5 mmol/l za hodinu. Pro spolehlivější stanovení glykémie se proto používají odběrové zkumavky s přídavkem fluoridu sodného, který inhibuje glykolýzu. Existují varianty jak s antikoagulačním činidlem (Na2EDTA nebo šťavelan draselný) pro získání plazmy, tak i bez antikoagulans pro přípravu séra.
Odběrové zkumavky s fluoridem mají šedou zátku.
Další a speciální odběrové zkumavky[upravit | editovat zdroj]
Komerčně je dostupná řada dalších variant odběrových zkumavek pro různé další účely – např. k odběru vzorků pro mikrobiologické kultivace, pro toxikologické analýzy, stanovení stopových prvků, s inhibitory peptidáz atd.
Další pomůcky pro odběr žilní krve[upravit | editovat zdroj]
Kvalitu materiálu ovlivňují i další pomůcky a zdravotnické prostředky použité pro odběr. Jejich správná volba je proto důležitou součástí preanalytické fáze vyšetření.
Dezinfekční prostředek[upravit | editovat zdroj]
Pro dezinfekci kůže se doporučují alkoholové dezinfekční prostředky, nejčastěji 70% 2-propanol. Kromě požadavků na antimikrobní účinnost je z hlediska preanalytické fáze vhodné, aby se dezinfekční prostředek rychle odpařoval. Kontaminace odebírané krve alkoholem totiž vede k hemolýze a tím ke znehodnocení vzorku pro řadu stanovení.
Jodové preparáty jsou pro odběr krve méně vhodné, neboť pokud i minimálně kontaminují vzorek, mohou ovlivnit řadu stanovení.
Injekční jehly[upravit | editovat zdroj]
S uzavřenými vakuovými odběrovými systémy se nejčastěji používají speciální oboustranné jehly. Při sestavování systému se z jehly sejme kryt (obvykle bílý nebo šedý) na straně, která směřuje do zkumavky. Tento konec jehly je chráněný ještě gumovým návlekem, aby při manipulaci nedošlo ke zranění. Jehla se zašroubuje do držáku. Těsně před odběrem se sejme druhý kryt (barva odpovídá průměru jehly), který chrání vlastní hrot, jímž se bude punktovat žíla. Nakonec, po zavedení jehly do žíly, se do držáku vsune odběrová zkumavka, přičemž se její víčko propíchne hrotem dosud krytým gumovým návlekem.
Jehla pro odběr krve musí mít vhodný průsvit. Použití příliš tenké jehly s vakuovým systémem způsobí velké tlakové rozdíly, což může vést k hemolýze. Současně se prodlouží doba odběru. Pokud odběr probíhá pomalu, je zpočátku ve zkumavce vysoká koncentrace činidel, což opět může vést k hemolýze. Naproti tomu příliš tlustá jehla způsobí větší ránu, odběr může být bolestivější a může dojít k poškození drobnějších žil.
Průměr injekčních jehel se tradičně vyjadřuje v tzv. birminghamské míře, Birmingham gauge, a značí se písmenem G. Vyšší číslo znamená tenčí jehlu. Pro odběry krve se používají jehly 23 G až 18 G.
| Barva | Birminghamská míra |
Vnější průměr (mm) |
Použití |
|---|---|---|---|
| 23 G | 0,64 | V pediatrii | |
| 22 G | 0,72 | ||
| 21 G | 0,82 | Nejčastější u dospělých | |
| 20 G | 0,91 | ||
| 18 G | 1,27 | Dlouhý odběr – darování krve |
Někdy je výhodnější místo jehly pevně připojené k držáku použít jehlu s křidélky (motýlek). S držákem zkumavky je spojená ohebnou hadičkou. Aby bylo možné ji držet při zavádění do žíly, jsou na ní ohebná plastová „křidélka“. Jehla s křidélky je vhodnou alternativou při obtížnějších odběrech. Je také pohodlnější při odběru velkého množství zkumavek a je bezpečnější při odběru krve neklidným a špatně spolupracujícím pacientům.
Některé jehly jsou vybavené bezpečnostním systémem, který po odběru zakryje hrot, aby se minimalizovalo riziko poranění.
Zaškrcovadlo[upravit | editovat zdroj]
Obecně platí, že končetina, ze které se odebírá krev, by měla být zaškrcena co nejkratší dobu, jinak může dojít ke změně řady měřených hodnot. Při dlouhém zaškrcení končetiny také roste riziko hemolýzy odebraného vzorku. Odběr by měl proběhnout do jedné minuty od nasazení zaškrcovadla. Zaškrcovadlo proto musí jít snadno nasadit a opět uvolnit.
V současnosti se dává přednost jednorázovým zaškrcovadlům, aby se snížilo riziku přenosu infekce mezi pacienty. Je třeba sledovat, z jakého materiálu je zaškrcovadlo vyrobené, zejména kvůli alergiím na latex.
Postup při odběru žilní krve[upravit | editovat zdroj]
- Připravte si pomůcky:
- odběrové zkumavky, jehlu a držák, stojánek na zkumavky,
- zaškrcovadlo, dezinfekci, tampóny nebo buničinu, náplast,
- nádoby na infekční a ostrý odpad,
- nesterilní rukavice,
- žádanky k odběru, psací potřeby,
- odběrové zkumavky s nalepenými identifikační štítky,
- sáčky pro transport biologického materiálu.
- Proveďte hygienickou dezinfekci rukou.
- Připravte a identifikujte pacienta.
- Představte se a vysvětlete, co budete dělat. Ujistěte se, že pacient s odběrem souhlasí.
- Významnou část preanalytických chyb tvoří záměna vzorků. Abyste jí předešli, vždy těsně před odběrem:
- požádejte pacienta, aby řekl své jméno a příjmení, a/nebo zkontrolujte jeho jméno na identifikačním náramku,
- zkontrolujte další údaj – např. číslo nemocničního lůžka, datum narození, jméno odesílajícího lékaře, adresu bydliště,
- obdobně zkontrolujte žádanky,
- zkontrolujte identifikační štítky na zkumavkách.
- Zjistěte, zda je pacient na něco alergický (zejména na dezinfekční prostředky, latex, náplast).
- Zjistěte, zda pacient neměl v minulosti nežádoucí reakci na odběr krve (např. mdlobu). Posuďte, zda není nepřiměřeně úzkostný a zda se odběru nebojí.
- Zajistěte pacientovi pro odběr bezpečnou a pohodlnou polohu v sedě nebo vleže. Končetina, ze které budete odebírat krev, vám musí být dobře přístupná a všechny pomůcky musíte mít pohodlně na dosah.
- Pod končetinu, ze které budete odebírat krev, dejte papírovou podložku.
- Vyhledejte místo, ze kterého budete provádět odběr. Žíla by měla být viditelná a hmatná i před přiložením zaškrcovadla. Není vhodné punktovat žíly v místě jejich větvení, zvyšuje se tím riziko hematomu.
- Zvolte vhodnou velikost jehly. Nasaďte jehlu do držáku („kloboučku“).
- Dezinfikujte místo vpichu.
- Dezinfekce se provádí od středu ke stranám. Podle použitého dezinfekčního prostředku by měla trvat kolem 30 sekund, poté by měl dezinfekční prostředek dokonale uschnout (dalších asi 30 sekund). Po dezinfekci se již místa vpichu nedotýkejte, jinak je nutné dezinfekci opakovat.
- Proveďte hygienickou dezinfekci rukou a nasaďte si rukavice.
- Přiložte zaškrcovadlo asi 8–10 cm nad zvolené místo.
- Zaveďte jehlu do žíly.
- Zafixujte žílu palcem pod místem vpichu.
- Požádejte pacienta, aby zatnul pěst.
- Jehlu zaveďte rychlým pohybem pod úhlem asi 30°.
- Naplňte zkumavky
- Zasuňte do držáku zkumavku a propíchněte její zátku jehlou. Zkumavka se začne plnit krví.
- Nyní požádejte pacienta, aby povolil pěst. Uvolněte zaškrcovadlo.
- Postupně naplňte všechny připravené zkumavky. Dle doporučení WHO se zkumavky odebírají v pořadí koagulace (citrát, světle modrá) – sérum (aktivátor koagulace, zlatožlutá) – plazma (heparin, zelená) – krevní obraz (EDTA, fialová) – glukóza (fluorid, šedá).
- Každou zkumavku nechejte naplnit až na předepsaný objem (přestane natékat krev). Zkumavky mívají vyznačenou hladinu krve na štítku.
- Jakmile naplněnou zkumavku vyjmete z držáku, opatrně ji promíchejte otáčením vzhůru nohama a zpět. Zkumavky pro přípravu séra (zlatožluté, červené) se mají tam a zpět otočit 5×, ostatní 8×.
- Po naplnění zkumavek přiložte na jehlu suchou buničinu nebo tampón a vytáhněte jehlu. Odložte jehlu do nádoby na ostré předměty. Komprimujte místo vpichu.
- Požádejte pacienta, ať dále komprimuje místo vpichu. Končetina se nemá pokrčovat v lokti, zvyšuje se tím riziko vzniku hematomu. Sledujte stav pacienta po odběru. Po zastavení krvácení přiložte náplast.
- Znovu zkontrolujte štítky na zkumavkách a žádanky. Vložte zkumavky a žádanky do transportního obalu.
- Dekontaminujte povrchy, sundejte si rukavice a proveďte hygienickou dezinfekci rukou.
Pořadí odebíraných zkumavek[upravit | editovat zdroj]
Při nasazování vakuované odběrové zkumavky do držáku a propichování její zátky se může odběrová jehla kontaminovat stopami činidla, které je na vnitřní straně zátky. I tato stopová kontaminace může mít vliv na výsledky některých stanovení. Zkumavky se proto odebírají v pořadí, které vznik chyb minimalizuje.
Jako první se plní zkumavky bez aditiv, pokud se používají, popřípadě vzorky, které vyžadují zvláštní čistotu odběru (např. tmavě modré zkumavky pro stanovení stopových prvků). Následuje citrátová plazma (světle modrá zátka) pro stanovení koagulačních parametrů a citrátová krev (černá zátka) pro sedimentaci erytrocytů. I minimální kontaminace aktivátorem koagulace nebo naopak jinými antikoagulačními činidly má na stanovení koagulačních parametrů a sedimentace nezanedbatelný vliv.
Další zkumavky následují v pořadí sérum s aktivátory koagulace (zlatožlutá nebo červená), plazma s lithiumheparinem (zelená), plná krev pro krevní obraz s EDTA (fialová) a další aditiva (např. šedé skumavky s fluoridem pro stanovení glukózy).
| Koagulace | Sérum | Plazma (statim) | Krevní obraz | Glukóza |
| Citrát | Aktivátory koagulace | Heparinát lithný | Draselné soli EDTA | Fluorid |
Hemolýza vzorku krve[upravit | editovat zdroj]
Poměrně častým problémem je hemolýza krve v průběhu jejího preanalytického zpracování. Při hemolýze se z krevních buněk uvolňují intracelulární součásti a dochází ke zkreslení řady výsledků. Je nemožné stanovit např. sérové koncentrace draslíku, bilirubinu, aktivitu AST či laktátdehydrogenázy a řada dalších stanovení je nepřesná.
K hemolýze může dojít i intravaskulárně v důsledku některých patologických stavů. Častěji k ní však dochází až během odběru krve nebo po něm a jde o důsledek nesprávné odběrové techniky. Mezi příčiny může patřit:
- Kontaminace vzorku dezinfekcí při odběru.
- Používejte alkoholovou dezinfekci, nechejte dezinfekční prostředek zaschnout.
- Příliš dlouhé přiložení zaškrcovadla, cvičení končetinou před odběrem.
- Zaškrcovadlo by mělo být utažené nejdéle jednu minutu.
- Velké rozdíly tlaků během odběru.
- Použijte silnější jehlu.
- Odběr krve z hematomu.
- Vyvarujte se nadměrné traumatizace tkáně a poškození cévy během odběru.
- Třepání vzorkem po odběru.
- Promíchání vzorku se provádí pomalým otáčením zkumavky. K mechanickému poškození může dojít i při přepravě potrubní poštou.
- Nedostatečné promíchání vzorku s činidly ve zkumavce.
- Zkumavku je třeba promíchat ihned po odběru. Dodržujte doporučené počty otočení zkumavky.
- Rychlé změny teploty.
- Zabraňte rychlému ochlazení vzorku po odběru nebo jeho zmrznutí během transportu.
Odkazy[upravit | editovat zdroj]
Externí odkazy[upravit | editovat zdroj]
Použitá literatura[upravit | editovat zdroj]
- DHINGRA, Neelam. WHO Guidelines on Drawing Blood : Best Practices in Phlebotomy. 1. vydání. WHO, 2010. 109 s. ISBN 9789241599221.
- ZIMA, Tomáš. Laboratorní diagnostika. 3. vydání. Galén, 2013. 1146 s. ISBN 9788074920622.
- RACEK, Jaroslav. Klinická biochemie. 2. vydání. Galén, 2006. 329 s. ISBN 9788072623242.
- TIETZ, Norbert. Tietz Textbook of Clinical Chemistry and Molecular Diagnostics. 4. vydání. Elsevier Saunders, 2006. 2412 s. ISBN 9780721601892.