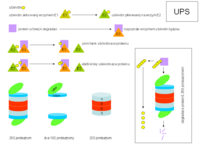
Ubikvitin-proteazomový systém
Degradace proteinů pomocí proteazomů je velice sofistikovaný proces, který se děje v rámci tzv. ubikvitin-proteazomového systému (UPS) neboli tzv. ubikvitin-proteazomové cesty (cesta anglicky pathway, tedy zkraka UPP). Významnou roli v tomto procesu hraje malý (76 aminokyselin, 8,5 kDa) protein ubikvitin, který byl objeven už v roce 1975, aniž by byla známa jeho funkce. Již z názvu však plyne, že tento protein se hojně vyskytuje ve všech eukaryotních buňkách (je „ubikvitní“ čili „všude se vyskytující“). Dnes už víme, že ubikvitin slouží ke značení proteinů v ději, jemuž říkáme ubikvitinace nebo ubikvitinylace proteinu. Význam, rozmanitost a komplexní kontext označování proteinů ubikvitinem dnes dosahuje úrovně dosud nejvýznamnější posttranslační modifikace proteinů, kterou je fosforylace[1].
Procesy ubikvitinace
- Ubikvitin je v buňce nejprve vázán (aktivován) za spotřeby ATP tzv. ubikvitin-aktivujícím enzymem E1.
- Následně je přenesen na ubikvitin-přenášející (nebo ubikvitin-konjugující) enzym E2.
- Další přesun ubikvitinu na protein, který má být degradován (dále PDG; nebo na vytvářející se řetězec ubikvitinů na PDG) je podmíněn ubikvitin-ligázou E3, která dokáže specificky rozpoznat proteiny, jež mají být degradovány.
Jinými slovy, enzymy E1 a E2 slouží převážně pouze k transportu ubikvitinů, naopak enzymy E3 obsluhují jejich konečné navázání na PDG, rozpoznaný právě těmito enzymy. Nejprve je tedy na PDG navázán první ubikvitin, na něj pak druhý, na druhý třetí atd. Z toho, že E3 enzymy specificky rozpoznávají různé PDG, plyne také to, že v buňkách je málo různých E1 (podle [2] existují v lidských buňkách přinejmenším dva E1 enzymy, totiž Uba6 a Ube1) a E2 enzymů, zatímco E3 enzymů existuje rozmanité množství (stovky) pro různé skupiny proteinů, určených k degradaci.
Ubikvitin-ligázy
Rozeznáváme základní dva rody ubikvitin-ligáz, které se liší přítomností aktivní domény: buď obsahují doménu HECT (homologous to E6-Associated Protein C-Terminus), nebo doménu RING (really interesting new gene) [3]-[4]. Navíc kromě klasické kaskády E1-E2-E3 dnes už známe také tzv. E4 enzymy, které se mohou podílet na prodlužování polyubikvitinového řetězce[5].
Způsob vazby ubikvitinů
Klíčovou otázkou je také to, jakým způsobem jsou ubikvitiny v řetězci navzájem spojeny. Nikoli každý polyubikvitinový řetězec je totiž prima facie polibkem smrti. Nejběžnější způsob vazby dvou ubikvitinů v polyubikvitinovém řetězci je přes lysin 48 (tzv. K48 řetězce) nebo lysin 63 (tzv. K63 řetězce), existují však i řetězce ubikvitinů vázané přes lysin 6, 11, 27, 29 či 33, výjimečně bývají tyto řetězce i rozvětvené[6]. Dnes neumíme přesně říci, jaký je význam celé pestrosti těchto signálů. Za „polibek smrti“ jsou považovány zejména K48 řetězce, zatímco K63 řetězce hrají především jiné role v buněčné signalizaci. Nedávno se však ukázalo, že také proteiny označené K63 řetězci mohou být rozpoznány proteazomy a degradovány v nich[7]. Existuje dokonce možnost, že K63 řetězce mohou být přeměněny přímo na označeném proteinu na K48 řetězce[8].
Deubikvitinace
V eukaryotní buňce dochází kromě ubikvitinace proteinů také k jejich deubikvitinaci. Enzymy zodpovědné za tento proces se nazývají deubikvitinázy a označují se zkratkou DUB. Můžeme je rozdělit do následujících pěti skupin:
- ubikvitin C-terminální hydrolázy,
- ubikvitin specifické proteázy,
- proteázy s doménou Machadovy-Josephovy nemoci,
- proteázy z vaječníkových tumorů,
- proteázy s JAMM doménou[9].
Dnes je známo 75 DUBů, které interagují se stovkami proteinů a hrají v eukaryotní buňce nesmírné množství různých rolí[10]. Poznamenejme, že jedna z JAMM doménových deubikvitináz, označovaná v lidských buňkách jako Poh1, je součástí eukaryotního proteazomu a hraje klíčovou roli při jeho správném fungování.
Odkazy
Související články
Zdroj
- CVEK, Boris. Od ubikvitinu k antabusu. Britské listy : deník o všem, o čem se v České republice příliš nemluví [online]. 2011, roč. -, s. -, dostupné také z <https://blisty.cz//legacy.blisty.cz/art/56680.html>. ISSN 1213-1792.
Reference
- ↑ KOMANDER, David. The emerging complexity of protein ubiquitination. Biochem Soc Trans [online]. 2009, vol. 37, no. Pt 5, s. 937-53, dostupné také z <https://www.ncbi.nlm.nih.gov/pubmed/19754430>. ISSN 0300-5127 (print), 1470-8752.
- ↑ JIN, Jianping, Xue LI a Steven P GYGI, et al. Dual E1 activation systems for ubiquitin differentially regulate E2 enzyme charging. Nature [online]. 2007, vol. 447, no. 7148, s. 1135-8, dostupné také z <https://www.ncbi.nlm.nih.gov/pubmed/17597759>. ISSN 0028-0836 (print), 1476-4687.
- ↑ ROTIN, Daniela a Sharad KUMAR. Physiological functions of the HECT family of ubiquitin ligases. Nat Rev Mol Cell Biol [online]. 2009, vol. 10, no. 6, s. 398-409, dostupné také z <https://www.ncbi.nlm.nih.gov/pubmed/19436320>. ISSN 1471-0072 (print), 1471-0080.
- ↑ DESHAIES, Raymond J a Claudio A P JOAZEIRO. RING domain E3 ubiquitin ligases. Annu Rev Biochem [online]. 2009, vol. 78, s. 399-434, dostupné také z <https://www.ncbi.nlm.nih.gov/pubmed/19489725>. ISSN 0066-4154 (print), 1545-4509.
- ↑ HOPPE, Thorsten. Multiubiquitylation by E4 enzymes: 'one size' doesn't fit all. Trends Biochem Sci [online]. 2005, vol. 30, no. 4, s. 183-7, dostupné také z <https://www.ncbi.nlm.nih.gov/pubmed/15817394>. ISSN 0968-0004.
- ↑ IKEDA, Fumiyo a Ivan DIKIC. Atypical ubiquitin chains: new molecular signals. 'Protein Modifications: Beyond the Usual Suspects' review series. EMBO Rep [online]. 2008, vol. 9, no. 6, s. 536-42, dostupné také z <https://www.ncbi.nlm.nih.gov/pmc/articles/PMC2427391/?tool=pubmed>. ISSN 1469-221X (print), 1469-3178.
- ↑ SAEKI, Yasushi, Tai KUDO a Takayuki SONE, et al. Lysine 63-linked polyubiquitin chain may serve as a targeting signal for the 26S proteasome. EMBO J [online]. 2009, vol. 28, no. 4, s. 359-71, dostupné také z <https://www.ncbi.nlm.nih.gov/pmc/articles/PMC2646160/?tool=pubmed>. ISSN 0261-4189 (print), 1460-2075.
- ↑ NEWTON, Kim, Marissa L MATSUMOTO a Ingrid E WERTZ, et al. Ubiquitin chain editing revealed by polyubiquitin linkage-specific antibodies. Cell [online]. 2008, vol. 134, no. 4, s. 668-78, dostupné také z <https://www.ncbi.nlm.nih.gov/pubmed/18724939>. ISSN 0092-8674 (print), 1097-4172.
- ↑ KOMANDER, David, Michael J CLAGUE a Sylvie URBÉ. Breaking the chains: structure and function of the deubiquitinases. Nat Rev Mol Cell Biol [online]. 2009, vol. 10, no. 8, s. 550-63, dostupné také z <https://www.ncbi.nlm.nih.gov/pubmed/19626045>. ISSN 1471-0072 (print), 1471-0080.
- ↑ SOWA, Mathew E, Eric J BENNETT a Steven P GYGI, et al. Defining the human deubiquitinating enzyme interaction landscape. Cell [online]. 2009, vol. 138, no. 2, s. 389-403, dostupné také z <https://www.ncbi.nlm.nih.gov/pmc/articles/PMC2716422/?tool=pubmed>. ISSN 0092-8674 (print), 1097-4172.