Signální sekvence polypeptidu, volné a vázané ribozómy
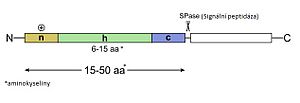
Cytosolové proteiny jsou syntezovány na volných cytosolových ribosomech, zatímco membránové bílkoviny, proteiny organel a bílkoviny uvolňované mimo buňku se syntezují na ribosomech vázaných na hrubé endoplazmatické retikulum (ER). Volné a vázané ribosomy jsou strukturně a funkčně zcela stejné, o jejich vazbě na ER rozhoduje sekvence syntezovaného řetězce. Většina proteinů určených mimo cytosol má na N-konci tzv. signální sekvenci o 13 - 16 aminokyselinách. I když se tyto sekvence od proteinu k proteinu liší, zastoupení několika hydrofobních aminokyselinových zbytků je zde charakteristické. Sekvence je rozpoznávána částicí SRP (signal recognition particle), skládající se ze šesti proteinových podjednotek a 7SL RNA. Naváže se na signální sekvenci syntezovaného proteinu a zastaví
translaci v počáteční fázi. Membrána ER obsahuje receptory pro SRP. Jakmile se na ně komplex ribosom-SRP naváže, pak za účasti dalších dvou membránových proteinů, riboforinu I a II, pokračuje proteosyntéza a současně petidový řetězec prochází membránou do cisterny ER. SRP se opět z receptoru uvolní do cytosolu.
Signální sekvence je pro translokaci rozhodující. Je-li genovou manipulací připojena k cytosolovému proteinu, např. hemoglobinu, pak je tato bílkovina uvolňována mimo buňku. Translokace peptidu je aktivní membránový proces, vyžadující energii (ATP). Prostup není poháněn translací, ribosomem. Teoreticky by mohl probíhat i po dokončení syntézy řetězce na volném ribosomu. Včasná vazba syntezovaného proteinu a ribosomu na ER je však výhodná a většinou potřebná, neboť po syntéze na volném ribosomu by protein mohl zaujmout konformaci, která by translokaci přes membránu znemožnila.
Těsný prostor mezi místem translace a translokace nedovolí, aby se řetězec konformoval dříve než na druhé straně membrány nebo v ní. Některé proteiny zůstanou zakotveny v membráně, což je dáno též jejich primární sekvencí.
Membránové proteiny totiž kromě signální sekvence mají ještě zakotvující, stop-transferasovou sekvenci, která translokaci přes membránu ukončí a protein zůstane zakotvenou součástí membrány. Signální sekvence těchto proteinů může být i poněkud vzdálená od N-konce. Některé mají takových sekvencí dokonce několik, střídají se se stop-transferovými úseky, takže jsou v membráně zakotveny několikerým způsobem, někdy i několikanásobně (viz obrázek). Signální sekvence sekretovaných proteinů bývá ještě v průběhu translokace odštěpena membránovou signalasou. Protein proniká do cisterny ER. Zde a zejména pak v Golgiho aparátu, je kovaletně modifikován (viz Posttranslační glykosylace proteinů) a potom dopraven na místo své funkce.
Odkazy[upravit | editovat zdroj]
Použitá literatura[upravit | editovat zdroj]
- ŠTÍPEK, Stanislav. Stručná biochemie : uchování a exprese genetické informace. 1. vydání. Praha : Medprint, 1998. ISBN 80-902036-2-0.