Sekvenování DNA
(přesměrováno z Metody sekvencování)
Sekvenace (vzácně též sekvencování) je souhrnný termín pro metody, které umožňují popsat pořadí nukleotidů v určitém úseku DNA. Těmito metodami lze nepřímo analyzovat i sekvenci RNA, je-li reverzní transkripcí převedena na DNA. V praxi jsou dnes používány především dvě metody založené na replikaci DNA – starší Sangerova sekvenace a novější, principem složitější sekvenování nové generace – Next Generation Sequencing.
Starší metody sekvenování (narozdíl od těch novějších) nepoužívají princip replikace, ale štěpení nukleové kyseliny.
Před určováním sekvence nukleotidů se nukleová kyselina nejdříve rozštěpí pomocí enzymu endonukleázy na kratší řetězce (oligonukleotidy). Částečným naštěpením oligonukleotidu např. fosfodiesterázou z hadího jedu lze získat směs štěpů lišících se o jeden nukleotid na 3'-konci (např. z CCUAGCA vznikne směs obsahující CCUAGCA, CCUAGC, CCUAG, CCUA, CCU, CC). Jednotlivé tyto štěpy jsou rozpoznány podle velikosti pomocí elektroforézy. V každé elektroforetické frakci je nutno zjistit zastoupení bazí. Tento postup byl principem první metody stanovení sekvence nukleotidů v RNA. Jeho zdlouhavost je zřejmá, popsaným způsobem bylo nutné analyzovat jednotlivé krátké oligonukleotidy a ty pak seřadit na základě analýzy aspoň dvou lyzátů výchozí nukleové kyseliny získaných dvěma různými endonukleázami s odlišnou specifitou.
Maxam a Gilbert nalezli rychlejší postup, když ke zjišťování primární struktury nukleových kyselin (sekvenování) použili chemické štěpení polynukleotidu u jednoho ze čtyř nukleotidů (pomocí dimetylsulfátu lze štěpit u guaninového, pomocí piperidinu u cytosinového nukleotidu apod.). Oligonukleotid se nejdříve označí na 5'-konci radioaktivním 32P a jeho roztok se rozdělí na čtyři stejné vzorky. Každý vzorek se naštěpí přednostně u jednoho ze čtyř nukleotidů. Zvolené podmínky umožní většinou jedno štěpení v molekule. Takže např. v oligonukleotidu 5'-32P-TACGTCGA se získají čtyři různé směsi štěpů.Tyto fragmenty se pak rozdělí polyakrylamidovou elektroforézou podle velikosti a frakce se detegují autoradiograficky nebo fluorescenčně. Sekvenci lze odečítat přímo z elektroforeogramu. Při hodnocení se postupuje od nejkratšího fragmentu a zaznamenává se typ lyzátu, ve kterém se štěp nachází (A, G, C nebo T).
Sangerovo sekvenování[upravit | editovat zdroj]
V roce 1977 Frederick Sanger vytvořil metodu sekvenování, za níž dostal v roce 1980 Nobelovu cenu. Základem je modifikovaná replikace DNA – v replikační směsi jsou smíchány standardní deoxyribonukleotidtrifosfáty (dNTPs) se speciálními dideoxyribonukleotidfosfáty (ddNPTs). Ty si jsou navzájem chemicky podobné, avšak chybějící OH skupina ddNTP neumožňuje další pokračování replikace.
Při moderním provedení probíhá reakce následovně – v reakční směsi je přítomna templátová (zkoumaná) DNA, DNA-polymeráza, sekvenační primery a dNTPs (tedy dATP, dGTP, dCTP, dTTP), tedy všechny substráty replikace. Dále směs obsahuje fluorescenčně označené ddNTPs. Spolu s pufrovacími roztoky, potřebnými ionty a dalšími stabilizátory se tato směs reagencií pro amplifikaci DNA metodou PCR označuje jako mastermix. DNA-polymeráza zde v úseku ohraničeném sekvenačními primery replikuje zkoumanou templátovou molekulu DNA, k čemuž používá směs dNTPs a ddNTPs. Tyto nukleotidy jsou začleňovány do řetězce na bázi komplementarity k templátové DNA stejně jako při běžné replikaci. Náhodně se začleňující ddNTPs však ukončují reakci za vzniku různě dlouhých fragmentů. Analýzou pomocí kapilární elektroforézy poté seřadíme jednotlivé fragmenty podle délky, takže koncové nukleotidy postupně se prodlužujících fragmentů vytvoří celistvou řadu, proběhlo-li dostatečné množství reakcí.
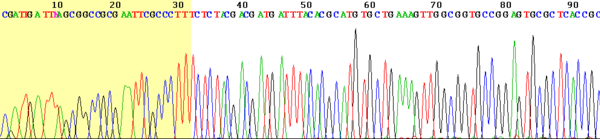
Fluorescenční peaky značící jednotlivé baze koncových ddNTPs umožní odečíst výslednou sekvenci. Taková data může analyzovat počítačový program. Prvních několik bazí je obvykle nehodnotitelných – v případě krátkých fragmentů dochází k nespecifickým vazbám a vzniká málo kýženého replikačního produktu. Je proto potřeba navrhovat primery dostatečně před místem, které je cílovou oblastí (targetem) pro sekvenování. Výsledek znázorňuje následující obrázek.
Příklad: V levém sloupci na obrázku vidíme různě dlouhé fragmenty končící adeninem, v ostatních sloupcích dalšími bazemi. Při seřazení všech fragmentů vedle sebe tak můžeme odečíst výslednou sekvenci DNA. Na obrázku vidíme, že při standardním zápisu od 5' konce ke 3' konci odečítáme sekvenci TACAG...
Next Generation Sequencing[upravit | editovat zdroj]
Sekvenování nové generace (z angl. next generation sequencing – NGS) je označení moderních metod sekvenování, které využívají bioinformatické metody ke zpracování velkého množství sekvenačních dat a jejich porovnání s referenčním genomem. Při NGS jsou zpracovávány tisíce až miliony sekvencí současně, což má za následek obrovské množství výstupních dat (proto někdy také nazýváno masivně paralelní sekvenování). Principy sekvenování jsou u jednotlivých výrobců odlišné, stejně tak se liší metody přípravy vzorku. Jedno spuštění sekvenátoru je oproti Sangerově metodě nákladnější a vyžaduje komplexnější vybavení a reagencie, avšak umožní sekvenování velkého množství zdrojové DNA za krátký čas a při dostatečném obratu i velmi nízkou cenu oproti Sangerově metodě. Při NGS lze sekvenovat dlouhé úseky DNA (až celý genom), více úseků DNA z jednoho vzorku, jeden úsek v mnoha opakováních pro zvýšení přesnosti měření či mnoho podobných úseků DNA z různých vzorků. Za posledních 20 let se cena sekvenování lidského genomu díky NGS snížila z řádu milionů dolarů na stovky.
Mezi jednotlivými metodami NGS jsou velmi zásadní odlišnosti. Dnes nejčastěji používanou metodou je sequencing by synthesis, mezi další principy patří pyrosekvenování, iontové polovodičové sekvenování či sekvenování ligací. Rozdíly jsou také v přípravě vzorků v závislosti na požadovaném postupu.
Příprava sekvenační knihovny[upravit | editovat zdroj]
Sekvenování nové generace předchází relativně dlouhá preanalytická fáze, při které vzniká roztok připravený pro sekvenování na daném přístroji, tzv. sekvenační knihovna:
- Nejprve je třeba (stejně jako u jiných metod sekvenace) izolovat DNA ze vzorku. Různými metodami docílíme odstranění buněčných membrán, proteinů, sacharidů, lipidů či dalších látek, jako jsou sloučeniny používané pro fixaci vzorku při jeho uchovávání.
- Po obdobném procesu izolace RNA je možné pomocí enzymu reverzní transkriptázy převést RNA na DNA a sekvenovat tak baze transkriptomu.
- V případě některých postupů jsou pomocí PCR amplifikovány části DNA, které chceme sekvenovat. Nejprve je však ověřena koncentrace vstupní DNA a celistvost fragmentů (tedy jsou-li izolované molekuly DNA dostatečně dlouhé a je jich ve vzorku potřebné množství pro analýzu). Některé z méně často používaných metod NGS přípravnou amplifikaci nepotřebují.
- V závislosti na vybrané metodě sekvenování je třeba adekvátně připravit vzorky a reakční směs sekvenátoru. Základními dvěma metodami přípravy knihovny je amplikonové a enrichmentové sekvenování:
- Při amplikonovém sekvenování využíváme konkrétně definované primery pro dané úseky DNA, které sekvenujeme. Úseky jsou krátké a jsou sekvenovány v mnoha opakováních. Můžeme se tak detailně s vysokou přesností zaměřit na konkrétní změny v sekvenci daného genu – tato metoda se nejčastěji využívá pro sekvenování mnoha kratších vzorků například při screeningu nádorových mutací u více pacientů.
- Enrichmentové sekvenování pracuje s mnohem delšími fragmenty, umožňuje tak efektivněji zkoumat delší úseky DNA, například při celogenomovém sekvenování, resekvenování či hledání nových či neznámých mutací v širší oblasti. Při této metodě jsou používány značené sondy, do amplifikace vstupují pouze specifické úseky vymezené těmito sondami po purifikaci na magnetických partikulích. Tímto krokem dochází ke snížení tvorby nežádoucích produktů amplifikace, vznikajících při amplikonovém sekvenování nespecifickým množením krátkých sekvencí při překrývání amplikonů.
- V závislosti na použité metodě je také různými způsoby označena příslušnost sekvence k danému vzorku – vzhledem k tomu, že je paralelně sekvenováno více vzorků, využívá se například značení indexy, což jsou krátké oligonukleotidy přidané na začátek či konec sledované sekvence. Některé z metod sekvenace vyžadují také připojení tzv. adaptorových sekvencí, které umožňují fixaci připravených fragmentů DNA k danému místu určenému pro jeho sekvenování.
Sekvenování syntézou a bioanalytika[upravit | editovat zdroj]
Sekvenování syntézou je nejčastěji používanou metodou vlastní sekvenace, v roce 2013 pokrývalo cca 90 % trhu [1]. Zde je tedy uvedeno jako nejčastější příklad zpracování vzorku po dříve popsané přípravě sekvenační knihovny.
Pomocí adaptorových sekvencí se přichytí analyzované fragmenty na flow-cell sekvenátoru (skleněná deska s miliony fixovaných oligonukleotidů komplementárních k adaptorovým sekvencím). Sledem dalších reakcí dochází k replikaci DNA a přichycení replikátů jako dalších templátů na flow-cell. Při sekvenování DNA polymerázy katalyzují probíhající replikaci s fluorescenčně značenými dNTPs, takže přístroj zaznamenává různé barevné signály pro jednotlivé baze v přesně definované síti vazebných míst flow-cell. Schematicky tento čtyřbarevný obraz flow-cell v jednom momentu ukazuje obrázek vpravo. Přístroj získá v několika čteních od jednoho vzorového fragmentu DNA stovky čtení v obou směrech.
Vzniklé „video“ zachycující miliony simultánně snímaných měnících se barevných bodů analyzuje počítačový program, který sestaví jednotlivé sekvence, přiřadí je pacientům/vzorkům podle indexových sekvencí, vyhodnotí podobnost měření stejných úseků a množství odchylek mezi měřeními a oproti referenčnímu genomu. Při tzv. alignmentu software vyhodnotí podle předepsaných dat, které úseky snímané při sekvenaci bude porovnávat s referenční sekvencí, a odstraní přebytečná data (nadbytečně sekvenované části DNA, nespecifické replikáty, sekvence primerů atd.)
Video popisující sequencing by synthesis[upravit | editovat zdroj]
Další metody NGS[upravit | editovat zdroj]
Různí výrobci využívají alternativních metod sekvenování nové generace. Pyrosekvenování využívá reversibilní terminace transkripce za pomoci několika propojených enzymatických reakcí. Tato metoda byla první NGS metodou uvedenou na trh, pro překonání jinými výrobci však byla výroba nových přístrojů původním výrobcem postupně ukončena po roce 2013 [2].
Sekvenování za pomoci ligace oligonukleotidů využívá značené reakce, při které enzym ligáza k primeru připojuje oligonukleotidy se známou sekvencí na bázi komplementarity k templátové DNA. Tato metoda má nejnižší míru chybovosti.
Další metody, jako je sekvenování na polovodičovém čipu či nanopórech, jsou málo používané.
Využití sekvenování v medicíně[upravit | editovat zdroj]
Jak Sangerovo sekvenování, tak NGS mají široké uplatnění ve více odvětvích medicíny. Jedná se o medicínu preventivní/prediktivní – využíváme biomarkery rizika vývoje onemocnění, například mutací BRCA; diagnostické analýzy umožňující potvrzení daného onemocnění či jeho rozsah (Huntingtonova chorea) a také vyšetření prediktivních či prognostických biomarkerů, které popisují závažnost daného onemocnění a jeho možnou léčbu. Příkladem těchto vyšetření je například hodnocení mutací HER-2/neu receptoru u nádorů prsu či mutací tyrozinkinázových signalizačních kaskád u kolorektálního karcinomu. Dále je sekvenování využíváno ve forenzní medicíně či mikrobiologii.
Sangerovo sekvenování je primárně používáno při nutnosti sekvenace malého množství krátkých vzorků. Při sekvenování většího množství dat jsou však jeho výhody ve většině případů překonány možnostmi NGS.
Odkazy[upravit | editovat zdroj]
Související články[upravit | editovat zdroj]
- Struktura nukleových kyselin
- Základní složky nukleových kyselin
- Primární struktura nukleových kyselin
- Štěpení nukleové kyseliny hydrolýzou
- Sekundární struktura DNA
- Denaturace nukleových kyselin, molekulární hybridizace
- Sekundární struktura RNA
- Topologie DNA
- Interakce DNA s proteiny
- Bakteriální chromozom
- Eukaryotické chromosomy
- DNA mitochondrií
Reference[upravit | editovat zdroj]
- ↑ REIFOVÁ, Radka. Sekvenování Nové Generace : Přednáška předmětu Genetické metody v zoologii [online]. Přírodovědecká fakulta Univerzity Karlovy, ©2013. [cit. 2021-06-14]. <http://web.natur.cuni.cz/zoologie/biodiversity/prednasky/GenetickeMetodyVZoologii/Prednasky_2013/NextGenerationSequencing_2013.pdf>.
- ↑ GenomeWeb. Roche Shutting Down 454 Sequencing Business [online]. Poslední revize 16-03-2013, [cit. 2021-06-14]. <https://www.genomeweb.com/sequencing/roche-shutting-down-454-sequencing-business>.
Externí odkazy[upravit | editovat zdroj]
- Illumina. NGS for beginners [online]. [cit. 2021-05-26]. <https://www.illumina.com/science/technology/next-generation-sequencing/beginners.html>.
- NOVOTNÁ, Marcela. Princip NGS metody [online]. ©2018. [cit. 2021-07-04]. <https://www.vuab.cz/princip-ngs-metody/>.
Použitá literatura[upravit | editovat zdroj]
- BEHJATI, Sam a Patrick S TARPEY. What is next generation sequencing?. Arch Dis Child Educ Pract Ed [online]. 2013, vol. 98, no. 6, s. 236-8, dostupné také z <https://doi.org/10.1136/archdischild-2013-304340>. ISSN 1743-0585 (print), 1743-0593.
- Přírodovědecká fakulta Jihočeské univerzity v Českých Budějovicích. Sekvenování, genomika (přednáška z předmětu Základy moderní biologie) [online]. [cit. 2021-05-24]. <https://www.prf.jcu.cz/zmb/menu/sekvenovani-genomika.html>.
- ŠTÍPEK, Stanislav. Stručná biochemie : Uchování a exprese genetické informace. 1. vydání. Medprint, 1998. 92 s. s. 13–14. ISBN 80-902036-2-0.