Elektroforéza nukleových kyselin
Úseky DNA, produkty PCR reakce nebo štěpy DNA můžeme v zásadě dělit chromatograficky nebo elektroforézou. Elektroforetické dělení je mnohem používanější. Provádí se zpravidla v gelu, a to buď agarosovém, nebo polyakrylamidovém. V obou případech se molekuly, které v zásaditém prostředí nesou záporný náboj, pohybují v elektrickém poli od katody k anodě. Gely tvoří poměrně hustou síť, kterou větší molekuly procházejí pomaleji než menší molekuly – mluvíme proto o technice molekulového síta.
Elektroforéza v agarosovém gelu[upravit | editovat zdroj]
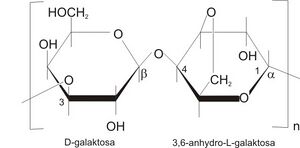
Agarosa je polysacharid tvořený D-galaktosou a anhydro-L-galaktosou, který produkují některé mořské řasy a pod názvem agar se používá k výrobě gelů v potravinářství, mikrobiologii, imunologii či biochemii. Pro elektroforézu nukleových kyselin se používají gely obsahující 0,5 až 4 % agarosy. Čím je obsah polysacharidu vyšší, tím je lepší rozlišovací schopnost gelu, ale tím je také průběh elektroforézy pomalejší a příprava gelu je technicky náročnější.
| Obsah agarosy v gelu | Délka DNA |
|---|---|
| 0,5 % | 1–30 kbp |
| 0,7 % | 0,8–12 kbp |
| 1,0 % | 0,5–10 kbp |
| 1,2 % | 0,4–7 kbp |
| 1,5 % | 0,2–3 kbp |
| 2,0 % | 50 bp–2 kbp |
| 3–4 % | 10 bp–1 kbp |
Do agarosového gelu se většinou přímo přidává ethidiumbromid, takže po skončení elektroforézy lze jednotlivé frakce zobrazit UV zářením. Jinou možností detekce je blotting na membránu a následné obarvení nukleových kyselin nebo hybridizace se značenými sondami.
Elektroforéza v polyakrylamidovém gelu[upravit | editovat zdroj]
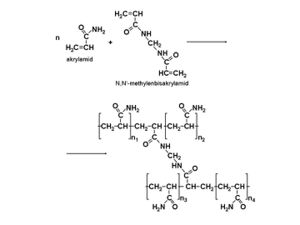
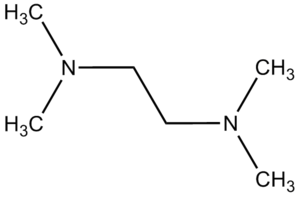
Jiným nosičem používaným při elektroforéze nukleových kyselin je polyakrylamidový gel. Polymerací akrylamidu vznikají lineární molekuly polyakrylamidu. Ty se spojují příčnými můstky, které vznikají kopolymerací s N,N‘-methylenbisakrylamidem. Akrylamid i methylenbisakrylamid jsou poměrně stabilní látky; polymerace probíhá v nepřítomnosti vzdušného kyslíku (odstraní se odvzdušněním pomocí vakua) a zahajuje se přimíšením katalyzátorů peroxydisíranu amonného (známého pod starším názvem persíran amonný, krátce APS) a N,N,N‘,N‘-tetramethylethylendiaminu (TEMED).
APS ve vodném roztoku s TEMED uvolňuje volné kyslíkové radikály, které atakují molekuly akrylamidu a bisakrylamidu a spouštějí tak jejich polymeraci.
Molekulové síto polyakrylamidového gelu je poměrně husté, hodí se proto pro rozdělování kratších fragmentů.
| Polyakrylamid | Délka DNA |
|---|---|
| 3,5 % | 1–2 kbp |
| 5 % | 75–500 bp |
| 8 % | 50–400 bp |
| 12 % | 35–250 bp |
| 15 % | 20–150 bp |
| 20 % | 5–100 bp |
Díky tomu, že polyakrylamid je méně reaktivní než agarosa, lze fragmenty DNA kromě metod používaných v agarosovém gelu obarvit i dalšími technikami. Z klasických metod patří mezi nejcitlivější stříbření, kterým lze detekovat množství DNA i o několik řádů nižší než ethidiumbromidem.