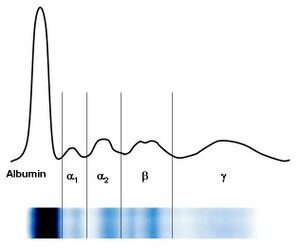
Elektroforéza bílkovin v séru
Jedním ze základních screeningových vyšetření je elektroforéza sérových bílkovin.
Princip elektroforézy sérových bílkovin[upravit | editovat zdroj]
Elektroforéza (ELFO) je založena na pohybu nabitých částic v elektrickém poli. Stanovované látky musí mít charakter iontů nebo amfolytů. Bílkoviny patří mezi amfolyty, které mohou nabývat kladného i záporného náboje v závislosti na pH pufru, při kterém elektroforéza probíhá. Je-li směs nabitých částic vystavena působení elektrického pole, začnou se molekuly látek pohybovat. Pohyblivost bílkovin je ovlivněna těmito faktory:
- charakterem dělené látky (velikost náboje, tvar a velikost molekul, relativní molekulová hmotnost);
- vlastnostmi prostředí, ve kterém dělení probíhá (hodnota pH, iontová síla, napětí, proud).
Pozitivně nabité molekuly proteinů se lépe adsorbují než negativně nabité molekuly, a proto při elektroforéze proteinů jsou využívány negativní náboje. Izoelektrický bod většiny sérových bílkovin je v oblasti slabě kyselé při pH 5–6. Proto v prostředí alkalického pufru, nejčastěji pH 8,6, budou u sérových bílkovin převažovat záporné náboje a jejich pohyb bude s různou rychlostí směřovat k anodě. Albumin vykazuje nejvyšší negativní náboj a tím i nejrychlejší pohyblivost k anodě.
Elektroforéza může probíhat na různých nosičích. Historicky nejstarším byl chromatografický papír. V klinicko-biochemické praxi se nejčastěji setkáváme s elektroforézou na acetátcelulózových foliích nebo na agarózovém gelu. Při elektroforéze, která využívá jako nosič papír nebo acetátcelulózu, putují molekuly bílkovin roztokem pufru, který je vně nosiče. Molekuly se tedy dělí především podle svého náboje. Podobně se budou dělit bílkoviny i v málo koncentrovaném agarózovém gelu.
Pomocí elektroforézy se bílkoviny krevního séra rozdělí obvykle na 5–6 frakcí – albuminovou, α1, α2, β, γ frakce se někdy rozliší na β1 a β2. S výjimkou albuminů jsou další frakce tvořeny vždy skupinou bílkovin, které mají přibližně stejnou elektroforetickou pohyblivost.
Provedení[upravit | editovat zdroj]
Kapka séra je přidána na sklíčko s elektroforetickým agorózovým gelem a rozprostřena po „startovní čáře“, kolmo na směr budoucího elektrického pole. Poté je vystavena účinkům elektrického pole v elektroforetické vaně. Vlivem elektrického pole začínají proteiny migrovat v agarózovém gelu.
Po uplynutí určité doby (např. 30 minut při napětí 120 V) se bílkoviny v gelu denaturují („fixují“), zpravidla působením alkoholů (metanolu) a kyselin (kyseliny octové). Tím se zabrání jejich difuzi nebo vymytí z gelu v dalších krocích. Poté se bílkoviny obarví vhodným organickým barvivem (např. amidočerní). Poloha jednotlivých frakcí a koncentrace bílkovin v nich se poté hodnotí pomocí denzitometrie.
- Více informací o elektroforéze formou on-line videa najdete např. na stránkách Masarykovy Univerzity.
Hodnocení elektroforézy sérových bílkovin[upravit | editovat zdroj]
| Název frakce | Hodnoty v relativních % | Hodnoty v g/l |
|---|---|---|
| Albumin | 55–69 | 35–44 |
| α1 | 1,5–4 | 1–3 |
| α2 | 8–13 | 5–8 |
| β | 7–15 | 4–10 |
| γ | 9–18 | 5–12 |
Charakteristika jednotlivých frakcí[upravit | editovat zdroj]
- Zóna prealbuminu
V této oblasti se pohybuje prealbumin (transtyretin), jehož zóna je však velmi diskrétní a těžko hodnotitelná.
- Zóna albuminu
Albumin vytváří poměrně širokou a z obou stran dobře ohraničenou zónu. Při poklesu koncentrace albuminu pod 30 g/l je patrné její oslabení. Vzácně pozorované zdvojení frakce je projevem genetické strukturní odchylky albuminu u heterozygotů – bisalbuminemie nebo vzniká při navázání cizorodé substance na albumin, např. penicilinu.
- Interzóna mezi albuminem a α1-globuliny
Slabé homogenní zbarvení této oblasti je podmíněno α1-lipoproteiny. Podobnou elektroforetickou pohyblivost vykazuje také α1-kyselý glykoprotein, ale zabarvení zóny ovlivňuje minimálně.
- Zóna α1-globulinů
Zónu α1-globulinů ovlivňuje především α1-antitrypsin. Při akutních zánětech je zřetelné zesílení. Klinicky významná je genetická variabilita α1-antitrypsinu, která se v elektroforéze může často zřetelně projevit oslabením, někdy až vymizením jeho zóny se současnou změnou pohyblivosti.
- Interzóna mezi α1 a α2-globuliny
Obvykle je celá slabě homogenně zbarvená.
- Zóna α2-globulinů
Na vytváření této zóny se podílejí především dvě bílkoviny – α2-makroglobulin a haptoglobin. Změny koncentrace α2-makroglobulinu nemají velký diagnostický význam. Haptoglobin vytváří 6 fenotypů, které se liší elektroforetickou pohyblivostí. Elektroforetické vyšetření neumožňuje rozlišení fenotypů haptoglobinu.
- Interzóna mezi α2 a β1-globuliny
Normálně se barví pouze slabě. Při hemolýze vznikají komplexy hemoglobin-haptoglobin, které v této oblasti vytvářejí samostatnou zónu.
- Zóna β1-globulinů
Tvar a intenzita zbarvení zóny β1-globulinů je ovlivněna prakticky pouze transferinem. Intenzita zóny dobře koreluje s celkovou vazebnou kapacitou plazmy pro železo. Při anemii z nedostatku železa a v těhotenství se zvyšuje syntéza transferinu a intenzita zóny se zesílí. Další protein s β1-elektroforetickou pohyblivostí, hemopexin, se špatně barví používanými barvivy a změny v jeho koncentraci se v elektroforéze neprojeví.
- Interzóna mezi β1 a β2-globuliny
V této oblasti nalézáme imunoglobulin IgA, který podmiňuje homogenní zbarvení zóny. Dále zde vytváří typickou linii β-lipoprotein, jejíž přítomnost závisí na jeho koncentraci.
- Zóna β2-globulinů
Na vytváření zóny β2-globulinů se podílí C3 složka komplementu. Podle intenzity zbarvení se dá těžko odhadnout koncentrace C3.
- Zóna γ-globulinů
Charakter zóny γ-globulinů je ovlivněn koncentracemi čtyř podtříd imunoglobulinu IgG. Zvýšení IgG se projeví intenzivnějším zbarvením a rozšířením zóny v obou směrech. Imunoglobulin IgM leží blíže startu. Samostatné nebo současné zvýšení koncentrace IgM pomocí elektroforézy nerozpoznáme.
Klinické využití[upravit | editovat zdroj]
Elektroforéza sérových bílkovin (ELFO) se provádí zejména, zjistíme-li patologický výsledek celkové bílkoviny, nebo potřebujeme-li podrobnější informaci o sérových bílkovinách. Zvlášť cenné je pro průkaz:
- dysproteinemie – změna koncentrace a kvalitativního složení jednotlivých bílkovin v séru,
- paraproteinemie – charakterizována přítomností monoklonálních imunoglobulinů.
ELFO u některých patologických stavů[upravit | editovat zdroj]
| Typ elektroforeogramu | Komentář | Alb | α1 | α2 | β | γ | Výskyt (příklad) |
|---|---|---|---|---|---|---|---|
| Akutní zánět |
|

|
| ||||
| ↓ nebo N | ↑ | ↑ | N | ||||
| Chronický zánět |
|

|
| ||||
| ↓ nebo N | N | N | N | ↑ | |||
| Chronický aktivní zánět |
|

|
| ||||
| ↓ | ↑ | ↑ | N | ↑ | |||
| Hepatální typ |
|

|
| ||||
| ↓ | ↓ | ↓ | ↓ | ↑ | |||
| Nefrotický typ |
|

|
| ||||
| ↓ | N | ↑ | ↑ | ↓ nebo N | |||
| Hypogamaglobulinemie |
|

|
| ||||
| N | N | N | N | ↓ | |||
| Monoklonální gamapatie |
|

|
| ||||
| ↓ | ↓ | ↓ | ↑ | ↑ | |||
Odkazy[upravit | editovat zdroj]
Související články[upravit | editovat zdroj]
Externí odkazy[upravit | editovat zdroj]
Video o elektroforetických metodách používaných v klinické biochemii pro vyšetření bílkovin v séru a moči