Genová kontrola tvorby protilátek
(přesměrováno z Genetická kontrola imunitní odpovědi)
Imunoglobuliny (Ig) jsou glykoproteiny vyskytující se:
- zakotvené v plazmatické membráně B-lymfocytů jako tzv. membránové nebo povrchové Ig (mIg) tvořící receptor;
- volně přítomné v krvi, lymfě i tkáňových tekutinách.
Kontakt mezi mIg a cizím antigenem je nutný pro indukci tvorby volných protilátek; membránové Ig na jedné buňce mají identickou vazebnou specifitu pro určitý epitop antigenu, ta je shodná s vazebnou specifitou protilátek, které jsou posléze produkovány plazmatickou buňkou. Většina receptorů B-lymfocytů je tvořena Ig typu IgM a IgD.
Struktura protilátek[upravit | editovat zdroj]
Protilátky se rozdělují do 5 tříd:
- IgA,
- IgD,
- IgE,
- IgG a
- IgM.
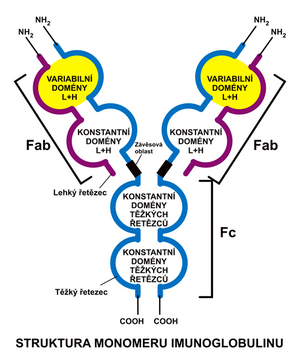
Jednotlivé třídy se liší velikostí, aminokyselinovým složením a obsahem sacharidů. Molekula Ig se skládá ze dvou identických lehkých (L – light) polypeptidových řetězců (212 AMK) a dvou řetězců těžkých (H – heavy, 450 AMK). Ty jsou navzájem spojeny disulfidickými můstky. Lehké řetězce jsou společné všem třídám, těžké řetězce jsou v jednotlivých třídách strukturně odlišné a určují, do které třídy Ig molekula patří. Lehké řetězce se vyskytují ve dvou formách:
- κ (kappa),
- λ (lambda).
Kterýkoli lehký řetězec se může kombinovat s kterýmkoli z těžkých řetězců. V jedné molekule protilátky se však vyskytují lehké řetězce pouze jednoho typu.
IgG[upravit | editovat zdroj]
Za hlavní Ig lidského séra lze považovat molekulu IgG. Lehké i těžké řetězce se skládají z konstantní a variabilní části. Konstantní části (CL, CH) mají ve všech protilátkách stabilní aminokyselinové složení (-COOH konec). Variabilní části (VL, VH) se liší počtem a sekvencí aminokyselin (-NH2 konec). V rámci variabilních oblastí lehkého i těžkého řetězce jsou krátké segmenty, které vykazují výjimečnou variabilitu, nazývané hypervariabilní oblasti, které vytvářejí povrchovou strukturu, jež je rozhodující pro specifickou vazbu na antigen.
Molekuly Ig lze enzymaticky rozštěpit např. papainem v oblasti mezi CH1 a CH2 (Hinge oblast), čímž vzniknou dva fragmenty:
- Fab fragment (fragment antigen binding), který váže antigen,
- Fc fragment (fragment crystalizable), který umožňuje vazbu na buňky imunitního systému.
Hinge oblast se vyznačuje určitou ohebností, což umožňuje lepší přizpůsobení vazebných oblastí antigenu.
Počet podjednotek[upravit | editovat zdroj]
- IgG, IgD i IgE – monomery
- IgM – pentamer složený z 5 podjednotek spojených přídatným peptidovým řetězcem J
- IgA – monomer, který prostřednictvím J řetězce vytváří v séru dimery.
Funkce protilátek[upravit | editovat zdroj]
Navázání protilátky na antigen může mít v řadě případů přímý efekt, např. neutralizaci bakteriálního toxinu nebo zabránění vniknutí viru do buňky. Ve většině případů je však nutná souhra sekundárních efektorových funkcí zprostředkovaných Fc částmi Ig. Tyto části reagují s buňkami, které exprimují Fc receptory, a napomáhají např. buněčně zprostředkované cytotoxicitě závislé na protilátkách a fagocytóze.
Komplex antigen–protilátka se prostřednictvím Fc receptoru naváže na povrch fagocytu, což umožní pohlcení antigenu a jeho destrukci.
Podstatou a jedinečnou vlastností imunitní odpovědi je schopnost tvorby enormního počtu různých typů protilátkových molekul, které se navzájem liší postupností aminokyselin. Může být až 108 rozdílných druhů protilátek. Tato obrovská rozmanitost se u savců vyvinula jako systém obrany před množstvím infekčních a toxických činitelů v životním prostředí, ale i před maligními buňkami, které vznikají v jejich vlastním těle.
Genetika[upravit | editovat zdroj]
Imunoglobulinové řetězce kódují tři odlišné rodiny genů.
- Rodina H je na chromosomu 14;
- Rodina κ (kappa) je na chromosomu 2;
- Rodina λ (lambda) je na chromosomu 22.
Uspořádání genů na chromosomu[upravit | editovat zdroj]
Variabilní a konstantní část každého řetězce je kódovaná oddělenými geny, jejichž funkční spojení vzniká až těsně před přepisem do mRNA.
Při tvorbě těžkých řetězců vystupuje ještě další úsek D (diversity – rozmanitost, protože variabilita tohoto úseku zodpovídá a rozmanitost typů těžkých řetězců). Tento úsek je kódovaný 1–12 minigeny D a je lokalizovaný mezi segmentem VH a segmenty JH a CH. Kód pro molekulu Ig se tedy může kombinovat z velkého množství rozmanitých genů buňky zárodečné linie. Umožňuje to obrovské množství protilátek, které se odlišují v pořadí aminokyselin. Další rozmanitost vyplývá z toho, že kombinace VJ a VDJ mohou vzniknout na vícero místech (přesmyk) a inzercí jedné nebo více aminokyselin mezi VH a DH, nebo mezi DH a JH (platí pro těžký řetězec).
Funkční domény imunoglobulinových genů jsou kódované úseky DNA, které jsou rozdělené introny.
Při tvorbě lehkých řetězců se uplatňuje mechanizmus exkluze alely, kde každá buňka má dvě sady genů κ a dvě sady genů λ a syntetizuje jen jeden typ lehkých řetězců.
V(D)J Rekombinace[upravit | editovat zdroj]
= mechanismus genetické rekombinace, který náhodně vybírá a spojuje segmenty genů kódujících specifické proteiny zásadní pro fungování imunitního systému.
Tento proces dává vzniknout rozmanitému množství molekul receptorů T (i B) buněk a imunoglobulinů, nezbytných k rozpoznávání množství antigenů, ať už pocházejících z cizorodých bakterií, virů, parazitů, nebo vlastních poškozených buněk, zejména nádorových.
Lidské protilátky (a receptory B buněk) sestávají z těžkých (heavy) a lehkých (light) řetězců s konstantními (C) a variabilními (V) oblastmi. Jednotlivé řetězce jsou kódovány třemi typy genů:
- Gen kódující těžký řetězec se nachází na 14. chromosomu
- Gen kódující lehký řetězec kappa (κ) se nachází na 2. chromosomu
- Gen kódující lehký řetězec lambda (λ) se nachází na 22. chromosomu
Množství genů kódujících variabilní oblasti každého z řetězců je seskupeno do tří segmentů. Lokus kódující těžký řetězec u člověka například obsahuje 65 genů ve V (variable) segmentu, 27 v D (diversity) segmentu a 6 v J (joining) segmentu.
Pro lehké řetězce také existuje mnoho genů V a J, geny D zcela chybí.
Většina receptorů T buněk sestává z α (alfa) a β (beta) řetězce. Geny pro tyto receptory, podobně jako pro imunogobuliny rovněž obsahují V, D a J segmenty v β řetězcích (a V a J segmenty v α řetězcích), které se během vývoje T-lymfocytů stejným způsobem přeskupují a dávají tak vzniknout buňce s jedinečným povrchovým receptorem.
V(D)J Rekombinace Imunoglobulinů[upravit | editovat zdroj]
Během vývoje B buněk dochází k první rekombinaci mezi jedním z D genů a jedním z J genů v lokusu pro těžký řetězec. Veškerá DNA mezi těmito geny je z genomu nenávratně vystřižena a odstraněna. Po této D-J rekombinaci následuje podobným způsobem připojení jednoho z V genů ke vzniklému DJ komplexu, čímž vzniká gen VDJ; veškeré geny mezi vybranými V a D geny jsou opět trvale odstraněny.
Postup - D+J = DJ+V = VDJ + C
Primární transkript (tj. nesestřižená RNA, dříve, než dochází ke splicingu) vždy obsahuje VDJ oblast a oba konstantní řetězce mí a delta (Cμ a Cδ; primární transkript tedy obsahuje segmenty V-D-J-Cμ-Cδ). Tato pre-mRNA je posttranskripčně modifikována přidáním poly (A) konce na 3'-konec mRNA a vystřižením sekvence mezi VDJ segmentem a Cμ řetězcem. Translace této mRNA pak vede k produkci těžkého řetězce imunoglobulinu M.
Lokusy pro kappa (κ) a lambda (λ) řetězce imunoglobulinů se přeskupují podobným způsobem, chybí zde však D segment. V prvním kroku rekombinace zde tedy dochází k vytvoření VJ komplexu, při transkripci pak k připojení genu pro konstantní oblast. Translace sestřižené mRNA kódující κ nebo λ řetězce pak vytváří samotný Igκ nebo Igλ protein.
Postup - V+J= VJ+C
Spojením těžkého řetězce Igμ s jedním z lehkých řetězců vzniká membránová forma imunoglobulinu IgM (tzv. B-buněčný receptor), který je exprimován na povrchu nezralých B buněk.
V(D)J Rekombinace T buněk[upravit | editovat zdroj]
Během vývoje T buněk dochází v genech pro receptory T buněk (TCR, T cell receptor) ke stejným procesům, které byly výše popsány u imunoglobulinů. D-J rekombinace nastává nejdříve v genu pro β řetězec TCR. Po D-J rekombinaci následuje Vβ-DβJβ přesmyk. Všechny geny mezi příslušnými Vβ-Dβ-Jβ geny jsou nenávratně odstraněny. Na konec primárního transkriptu se vedle zmíněného VβDβJβ řetězce začleňuje gen pro konstantní oblast proteinu, Cβ. RNA splicing vystřihne všechny nadbytečné sekvence a hotovou mRNA lze posléze přeložit do formy Cβ řetězce TCR.
Postup - D+J = DJ+V = VDJ + C
Přeskupení α řetězce TCR je analogické přeskupení β řetězce a podobá se V-J rekombinaci lehkých řetězců imunoglobulinů (viz výše). Spojení α a β řetězců dává vzniknout αβ-TCR, které na svém povrchu exprimuje většina T buněk.
Odkazy[upravit | editovat zdroj]
Reference[upravit | editovat zdroj]
Použitá literatura[upravit | editovat zdroj]
- ŠTEFÁNEK, Jiří. Medicína, nemoci, studium na 1. LF UK [online]. [cit. 11. 2. 2010]. <https://www.stefajir.cz/>.