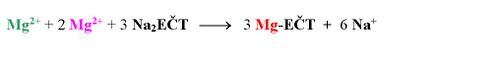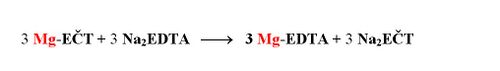Ionty v pitné vodě
Složení pitné vody[upravit | editovat zdroj]
Voda vyskytující se v přírodě obsahuje směs rozpuštěných solí a sloučenin. Pitnou vodou se rozumí taková voda, jejíž fyzikálně-chemické vlastnosti nepředstavují ohrožení zdraví. Ukazatelé zdravotní nezávadnosti a čistoty pitné vody jsou podrobně specifikovány ve vyhlášce Ministerstva zdravotnictví ČR 252/2004 Sb. Hodnota ukazatele jakosti pitné vody, jejíž překročení obvykle nepředstavuje akutní zdravotní riziko, se označuje jako mezní hodnota. Nejvyšší mezní hodnotou se rozumí hodnota zdravotně závažného ukazatele jakosti pitné vody, v důsledku jejíhož překročení je vyloučeno použití vody jako pitné.
Minerální vody obsahují v 1 litru více než 1 g rozpuštěných solí. Vysoký obsah Ca2+ nebo Mg2+ mají vody zemité (např. „Rudolfův pramen“, „Hanácká kyselka“, které obsahují hydrogenkarbonát vápenatý, „Magnesia“ obsahující hydrogenkarbonát hořečnatý) nebo např. hořké („Šaratice“ s obsahem síranu hořečnatého).
Řada iontů přítomných ve vodě je pro lidský organismus velmi důležitá, některé jsou však nežádoucí, při vyšších koncentracích toxické. Z iontů se sledují v pitné vodě např. ionty Ca2+ (samotné nebo spolu s ionty Mg2+), Fe3+, NH4+, NO2− a NO3−.
Vápenaté a hořečnaté ionty (tvrdost vody)[upravit | editovat zdroj]
Koncentrace vápenatých a hořečnatých solí je jedním z ukazatelů kvality vody a bývá označována jako tzv. tvrdost vody. Kationty Ca2+ a Mg2+ jsou velmi důležité pro lidský organismus, jejich přítomnost je tedy žádoucí. Vysoké množství Ca2+ a Mg2+ kationtů zhoršuje část užitných vlastností vody – usazování nerozpustných zbytků (tzv. kotelní kámen) na stěnách nádob, snižování účinnosti mýdel apod.
Ze zdravotního hlediska doporučené koncentrace v pitné vodě:
- Ca2+ 40–80 mg/l
- Mg2+ 20–30 mg/l
Podle množství Ca2+ a Mg2+ solí je rozlišována:
- Přechodná tvrdost vody
- je tvořená vápenatými a hořečnatými uhličitany a hydrogenuhličitany. Za dané teploty a tlaku existuje v roztoku rovnováha mezi rozpuštěným oxidem uhličitým a hydrogenuhličitany. Zahříváním roztoku uniká z něho oxid uhličitý, čímž se porušuje rovnováha, což vede k postupné přeměně hydrogenuhličitanu na uhličitan. Málo rozpustný uhličitan vápenatý se vysráží na stěnách nádoby nebo na povrchu topných těles ve formě tzv. vodního kamene.
- Trvalá tvrdost vody
- je tvořená rozpuštěnými solemi vápenatými a hořečnatými, kromě uhličitanů a hydrogenuhličitanů, tj. sírany, chloridy, dusičnany a křemičitany.
- Celková tvrdost vody
- je součtem trvalé a přechodné tvrdosti.
*Celková tvrdost vody se udává též v německých stupních tvrdosti °dH, °N. Definice jednotky °dH: 1 °dH ≈ 10 mg/l CaO resp. MgO. Přepočet tvrdosti vody z °dH na mmol/l: 1 mmol/l (Ca2+ + Mg2+) ≈ 5,6 °dH; 1 °dH ≈ 0,18 mmol/l (Ca2+ + Mg2+).Označení vody dle stupňů tvrdosti* Koncentrace Ca2+ + Mg2+ (mmol/l) Příklad Velmi měkká < 0,5 dešťová voda Měkká 0,7–1,25 voda z nerozpustných podloží Středně tvrdá 1,26–2,5 vodovodní voda Tvrdá 2,6–3,75 studniční voda Velmi tvrdá > 3,8 voda z vápencových oblastí
Stanovení souhrnného obsahu vápenatých a hořečnatých iontů v pitné vodě[upravit | editovat zdroj]
Principem stanovení je chelatometrická titrace – jedna z metod odměrné analýzy. Při titraci kationty přítomné v roztoku vytvářejí s některými aminopolykarboxylovými kyselinami komplexy, které jsou sice rozpustné, ale jsou velmi málo disociované. Titračním činidlem je nejčastěji roztok disodné soli ethylendiamintetraoctové kyseliny, zkráceně Na2EDTA (chelaton 3, komplexon III). Na2EDTA vytváří s polyvalentními kationty chelátové komplexy, v nichž je poměr kovu a EDTA vždy 1:1.
K indikaci bodu ekvivalence slouží při komplexometrii tzv. metalochromní indikátory – barevné látky, které tvoří s ionty kovů rovněž komplexy. Metalochromním indikátorem při stanovení Mg2+ v alkalickém prostředí je eriochromčerň T (EČT). Roztok EČT je za podmínek titrace (pH 11) zbarven modře. Chelátový komplex eriochromčerňi T s Mg2+ (EČT–Mg) je zbarven vínově červeně.
Při stanovení koncentrace samotných hořečnatých iontů se využívá skutečnosti, že komplex EČT-Mg je méně stabilní než chelát Mg-EDTA.
Za přítomnosti eriochromčerni T se v bodě ekvivalence mění vínově červené zbarvení komplexu EČT-Mg na modré zbarvení samotného indikátoru EČT.
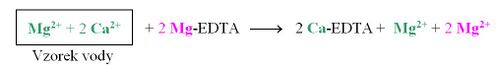
Současné stanovení Ca2+ a Mg2+ je pak založeno na tom, že chelát Ca-EDTA je stabilnější než chelát Mg-EDTA. Na počátku titrace se k roztoku vzorku vody přidá roztok chelátu Mg-EDTA. Jsou-li v roztoku přítomny vápenaté a hořečnaté ionty v poměru např. 2:1, dojde k reakci:
Tímto se všechny kationty Ca2+ v roztoku nahradí kationty Mg2+, které vytvoří s přidaným indikátorem vínově červený komplex:
Následující chelatometrická titrace proběhne pouze s Mg2+, které představují souhrn Ca2+ a Mg2+ v původním vzorku. Konec titrace se projeví čistě modrým zbarvením indikátoru.
Úkol: Stanovení souhrnného obsahu vápenatých a hořečnatých iontů v pitné vodě – pdf
Dusičnany[upravit | editovat zdroj]
Dusičnany nejsou samy o sobě toxické, zčásti jsou však mikroflórou ústní dutiny, při některých infekcích i střevní mikroflórou, redukovány na toxické dusitany. Tato skutečnost může být významná při požití většího množství dusičnanů.
Přijatelný denní příjem je 4–5 mg NO3−/kg tělesné hmotnosti, přitom podíl příjmu NO3− pitnou představuje průměrně třetinu.
Nejvyšší mezní hodnota NO3− v pitné vodě je 50 mg/l.
Pro splnění podmínek jakosti pitné vody musí být dodržena následující podmínka:
Voda pro kojence z pohledu prevence dusičnanové alimentární methemoglobinaemie může obsahovat jen do 15 mg NO3−/l.
V potravě je nejvyšší obsah dusičnanů v některých druzích zeleniny (zvláště kořenové), kde často přesahuje hodnotu 1000 mg/kg. Nejméně dusičnanů obsahuje plodová zelenina, nejvíce červená řepa, skleníkové ředkvičky a saláty. Vysoká koncentrace NO3− ve vodním zdroji signalizuje zpravidla průnik vody vrstvami se značnou úrovní biologických dějů, a tedy značnou pravděpodobnost bakteriální kontaminace.
Důkaz dusičnanů ve vodě pomocí difenylaminu[upravit | editovat zdroj]
Dusičnany oxidují v prostředí koncentrované H2SO4 difenylamin na modře zbarvený produkt.
Stejnou reakci poskytují i dusitany (a to i v prostředí zředěné H2SO4), ty však lze prokázat specifickou diazotační reakcí.
Úkol: Důkaz dusičnanů ve vodě pomocí difenylaminu – pdf
Stanovení dusičnanů ve vodě pomocí salicylové kyseliny[upravit | editovat zdroj]
Ionty NO3− reagují v silně kyselém prostředí se salicylovou kyselinou. Salicylová kyselina se nitruje a po alkalizaci poskytuje žlutý nitrosalicylát, který se stanoví spektrofotometricky při 410 nm.
Úkol: Stanovení dusičnanů ve vodě pomocí salicylové kyseliny – pdf
Orientační stanovení dusičnanů ve vodě pomocí proužků Nitrotest[upravit | editovat zdroj]
Dusičnany jsou pomocí redukčního činidla, obsaženého v indikační zóně proužku, redukovány na dusitany. Z dusitanů je silně kyselým pufrem vytěsněna kyselina dusitá, která diazotuje aromatický amin. Jeho kopulací s N-(1-naftyl)-ethylendiaminem vzniká červenofialově zbarvená azosloučenina. Intenzita zabarvení zóny je úměrná koncentraci dusičnanů přítomných ve vzorku.
Jsou-li ve vzorku přítomny vedle dusičnanů i dusitany, zbarvení zóny odpovídá jejich součtu.
Úkol: Orientační stanovení dusičnanů ve vodě pomocí proužků Nitrotest – pdf
Stanovení dusičnanů ve vodě pomocí iontově selektivní elektrody[upravit | editovat zdroj]
Měří se elektromotorické napětí E nezatíženého galvanického článku tvořeného dusičnanovou iontově selektivní elektrodou (ISE) a referentní argentchloridovou elektrodou s dvojitým solným můstkem s roztokem K2SO4 jako můstkovým elektrolytem (SO42− ionty neovlivňují potenciál dusičnanové ISE). Měrnou částí dusičnanové ISE je pevná plastová membrána, ve které je jako změkčovadlo rozpuštěn ionofor citlivý na NO3− ionty. ISE mění svůj elektrický potenciál podle Nernstova vztahu, tzn. úměrně logaritmu aktivity dusičnanových iontů aNO3− v roztoku v rozmezí 10−6–10−1 mol/l:
- E = konst. − 59,2×log(aNO3− + koef. selektivity × ainterferujících iontů)
Pro dostatečnou přesnost měření musí platit:
- aktivita NO3− >> (koef. selektivity × aktivita interferujících iontů).
Pokud není splněna výše uvedená podmínka, je nutno interferující ionty odstranit, např. vysrážením nebo maskováním v komplexu.
Interferující ionty pro dusičnanovou ISE jsou v pořadí: nejvíce ClO4− >> I− > Br− >> HCO3− > NO2− > Cl− >> H2PO4−, SO42−.
Membrána je velmi citlivá na lipofilní látky, které membránu nenávratně poškozují. Pro stanovení koncentrace dusičnanů se zhotoví kalibrační graf: změřené napětí E několika kalibračních roztoků o známé koncentraci iontů NO3− je vyneseno do grafu jako závislost napětí E na logaritmu koncentrace NO3−. Ze změřeného napětí E v neznámém vzorku lze pak v grafu odečíst hodnotu log c(NO3−) a odlogaritmováním získat c(NO3−) v jednotkách mol/l.
Obdobným způsobem lze stanovit obsah dusičnanů v zeleninových šťávách nebo extraktech.
Úkol: Stanovení dusičnanů ve vodě pomocí iontově selektivní elektrody – pdf
Dusitany[upravit | editovat zdroj]
Dusitany jsou toxické (pro člověka od několika desítek miligramů), způsobují kromě jiného oxidaci hemoglobinu na hemiglobin (methemoglobin) nebo reagují v trávicím traktu se sekundárními aminy, resp. amidy přijatými potravou za vzniku nitrosaminů, resp. nitrosamidů, z nichž některé jsou silně karcinogenní. Vznik nitrosaminů/nitrosamidů je silně potlačen při současném podání vitaminu C.
Dle vyhlášky nejvyšší mezní hodnota NO2− v pitné vodě je 0,5 mg/l.
Přítomnost dusitanů ve vodě znamená zpravidla značné znečištění vody při jejím prostupu vysoce biologicky aktivními vrstvami.
Důkaz dusitanů[upravit | editovat zdroj]
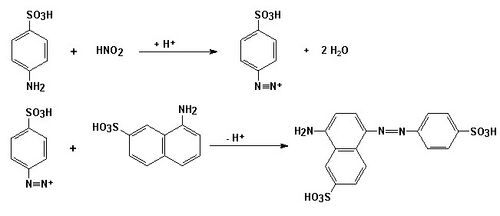
Specifickou a velmi citlivou reakcí na důkaz dusitanů je diazotační reakce, při níž reaguje dusitan se sulfanilovou kyselinou v prostředí octové kyseliny za vzniku diazoniové soli, která kopuluje s 1-naftylamin-7-sulfonátem za vzniku červenofialového azobarviva:
Metodu lze využít i ke kvantitativnímu fotometrickému stanovení dusitanů.
Úkol: Důkaz dusitanů diazotační reakcí – pdf
Amonné ionty[upravit | editovat zdroj]
Nejvyšší mezní koncentrace NH4+ v pitné vodě je 0,5 mg/l.
Poměr NH4+/NH3 v roztoku závisí na hodnotě pH.
Přítomnost kationtů NH4+ (nebo amoniaku v alkalických vodách) je většinou ukazatelem hrubého znečištění pitné vody produkty rozkladu dusíkatých organických látek, hlavně proteinů a močoviny (průsaky z kanalizace, žump, silážních jam, aj.).
Důkaz amonných iontů[upravit | editovat zdroj]
Na důkaz iontů NH4+ lze použít Nesslerovo činidlo (alkalický roztok K2[HgI4]).
Reakce je využívána i k fotometrickému stanovení amoniaku a amonných solí.
Úkol: Důkaz amonných iontů – pdf
Stanovení amoniaku zpětnou titrací[upravit | editovat zdroj]
Amoniak je těkavá látka a během titrace dochází ke značným ztrátám. Proto při stanovení amoniaku se používá zpětná titrace. Podstata zpětné titrace spočívá v přidaní přebytku roztoku HCl, který zreaguje s amoniakem za vzniku NH4Cl.
- NH3 + HCl → NH4Cl
Nadbytek roztoku HCl se následně titruje odměrným roztokem NaOH.
Úkol: Stanovení amoniaku zpětnou titrací – pdf
Anionty kyseliny fosforečné[upravit | editovat zdroj]
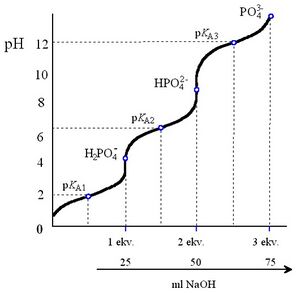
Kyselina trihydrogenfosforečná je trojsytná kyselina (pKA1 = 2,1; pKA2 = 7,2; pKA3 = 12,3). Je stálá, nemá oxidační vlastnosti.
Z pKA hodnot vyplývá, že do 1. stupně disociuje jako středně silná, do 2. stupně jako slabá a 3. stupně jako velmi slabá kyselina.
Ověření rozpustnosti fosforečnanů v závislosti na pH roztoku[upravit | editovat zdroj]
V roztocích fosforečnanů existují v závislosti na pH ionty H2PO4− jen za kyselé a neutrální reakce, ionty HPO42− v roztocích mírně kyselých až alkalických a ionty PO43− pouze ve značně alkalických roztocích. Okyselením roztoků přechází fosforečnany na hydrogenfosforečnany a dihydrogenfosforečnany, alkalizací se posunuje rovnovážný stav až k fosforečnanům.
Změny probíhající v roztocích fosforečnanů v závislosti na pH vystihuje titrační křivka kyseliny fosforečné.
Úkol: Ověření rozpustnosti fosforečnanů v závislosti na pH roztoku – pdf
Anionty kyseliny uhličité[upravit | editovat zdroj]
Kyselina uhličitá je velmi nestálá, slabá kyselina (pKA1' = 6,4, pKA2' = 10,3). Z roztoku ji lze úplně vypudit zahřátím ve formě CO2.
Důkaz uhličitanů a hydrogenuhličitanů v roztoku[upravit | editovat zdroj]
Úkol: Důkaz uhličitanů a hydrogenuhličitanů v roztoku – pdf