Chromatografie
Chromatografie jsou fyzikálně-chemické separační metody, jejichž podstatou je rozdělování složek směsi vzorku mezi dvě fáze, a to fázi nepohyblivou (stacionární fázi) a pohyblivou (mobilní fázi). Tyto dvě fáze se od sebe odlišují některou základní fyzikálně-chemickou vlastností, např. polaritou. Spolu s pohybující se mobilní fází je soustavou unášen také vzorek. Dělené složky vzorku (analyty) interagují v různé míře se stacionární a mobilní fází. Analyty, které se poutají více ke stacionární fázi, se pohybují pomaleji a jsou zadržovány déle, než analyty, které se ke stacionární fázi poutají méně. Na základě tohoto principu dochází k rozdělení složek směsi.
viz též heslo Chromatografie v české Wikipedii a heslo Chromatography v anglické Wikipedii
Rozdělení chromatografických metod
- Podle fyzikálně chemického principu dělení
- Adsorpční chromatografie
- Rozdělovací chromatografie
- Iontově výměnná chromatografie
- Gelová chromatografie
- Afinitní chromatografie
- Podle skupenství mobilní fáze
- Kapalinová chromatografie
- Plynová chromatografie
- Podle uspořádání stacionární fáze
- Kolonová (sloupcová) chromatografie
- Kapilární chromatografie
- Chromatografie na tenké vrstvě (tenkovrstvá chromatografie)
- Chromatografie na papíře
- Podle účelu použití
Základní chromatografické termíny
- Analyt – látka, která má být pomocí analytické metody stanovena/izolována
- Eluent – mobilní fáze použitá pro separaci analytů
- Eluční roztok/činidlo – kapalina, kterou promýváme chromatografickou kolonu během vlastního dělení u sloupcových chromatografií za účelem vymývání frakcí vzorku z kolony. Eluční činidlo je vždy mobilní fází, ne všechnu mobilní fázi však můžeme považovat za eluční činidlo (např. samotný vzorek či původní roztok v koloně před vlastním dělením).
- Efluent/eluát – mobilní fáze vytékající z kolony
- Chromatograf – zařízení, umožňující chromatografii. Skládá se z několika součástí. Kapalinový chromatograf vždy obsahuje zařízení pro uchovávání a transport mobilní fáze (vysokotlaké čerpadlo = pumpu), zařízení pro dávkování vzorku (dávkovač, autosampler), zařízení pro separaci látek (chromatografická kolona) a zařízení pro detekci látek. Volitelné součásti chromatografu jsou odplyňovač mobilní fáze, termostat kolony, sběrač frakcí, u gradientové eluce směšovač mobilních fází. Signál z detektoru bývá většinou veden do integrátoru v PC.
- Chromatogram – grafický výstup z detektoru vznikající během chromatografického procesu vyjadřující závislost signálu (osa y) na elučním čase nebo objemu (osa x)
- Mobilní fáze – kapalina nebo plyn, které unášejí složky dělené směsi přes tzv. stacionární fázi.
- Nosič – pevná, z hlediska dělení pokud možno inertní látka, se kterou je spojena zakotvená fáze. Nosič tak zajišťuje, že na něm zakotvená fáze bude nepohyblivou stacionární fází.
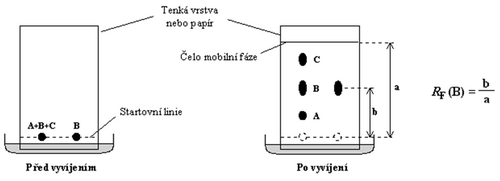
- Retardační faktor – je poměr vzdálenosti čela od startu a vzdálenosti středu skvrny sledované látky od startu při plošných chromatografiích. U plošných chromatografií je však reprodukovatelnost sporná a proto se s tabelací RF nesetkáváme. Hodnoty RF se mohou pohybovat od RF = 0 pro látky vyvíjecím činidlem za daných podmínek neunášené (zůstávají na startu) až po RF = 1 pro látky zcela nezdržované stacionární fází a unášené s čelem.
- Retenční/eluční čas nebo objem – čas od začátku eluce, který je potřebný k tomu, aby se daná frakce vzorku dostala k detektoru za kolonou, nebo objem elučního činidla, který proteče za eluční čas kolonou. Jsou-li použity dobře definované kolony (např. některé komerční kolony pro HPLC nebo pro kapilární plynovou chromatografii) za předepsaných podmínek, lze retenční časy či objemy pro různé dělené látky tabelovat, neboť jsou dobře reprodukovatelné.
- Stacionární fáze – pevná látka nebo s ní nepohyblivě spojený povlak kapaliny, která je vlastní účinnou složkou chromatografického zařízení (kolony nebo plošné vrstvy).
- Teoretické patro – výšková část kolony, ve které průměrně teoreticky dochází k jednomu rovnovážnému dělícímu kroku fyzikálně chemického jevu (např. adsorpce/desorpce u sorpční chromatografie, rozpuštění látky v zakotvené fázi a její zpětné rozpuštění nebo vypaření do mobilní fáze apod.). Netýká se ionexové a afinitní chromatografie. Tento pojem však nemá s realitou mnoho společného a je opravdu jen „teoretický“.
- Účinnost kolony – je úměrná počtu teoretických pater dané kolony. U ionexové a afinitní chromatografie místo o účinnosti hovoříme spíše o kapacitě kolony. O kapacitě kolon však hovoříme u všech preparativních kolonových chromatografií. Naproti tomu zvláště u analytických kolonových chromatografií nás zajímá rozlišovací schopnost kolony, kterou charakterizujeme tzv. separačním číslem, což je, zjednodušeně řečeno, počet rozlišitelných píků mezi dvěma vybranými mezními.
- Vyvíjecí roztok/činidlo – mobilní fáze při plošných chromatografiích.
- Zakotvená fáze – vrstva kapaliny relativně pevně spojená s pevnou látkou. Tvoří vlastní stacionární fázi u rozdělovací chromatografie.
Adsorpční chromatografie
Je založena na rozdílné adsorpci látek na povrchu sorbentu, tvořícího stacionární fázi. Látky, které jsou za daných podmínek silněji vázány sorpčními silami, jsou v jednotlivých úsecích (např. v teoretickém patru) častěji a déle naadsorbovány než látky jiné. Makroskopicky jsou stacionární fází více zdržovány a mobilní fází tak pomaleji unášeny. V kolonových metodách jsou proto charakterizovány vyššími elučními časy nebo většími elučními objemy, v plošných technikách potom menšími hodnotami retenčního faktoru.
Sorbenty, používané v adsorpční chromatografii jako stacionární fáze, se od sebe liší svou polaritou případně kyselostí.
Extrémně nepolárním sorbentem je aktivní uhlí, resp. moderní uhlíkové sorbenty.
Z polárních kyselých sorbentů je třeba jmenovat alespoň silikagel (hydratovaný oxid křemičitý SiO2.xH2O).
Příkladem polárních bazických sorbentů jsou hydratované oxidy hlinitý a hořečnatý: Al2O3.xH2O a MgO.xH2O.
Často se jako sorbenty používají organické (ko)polymery nejrůznějšího složení, a tedy i fyzikálně chemických vlastností.
Mobilní fázi vybíráme z tzv. eluotropní řady rozpouštědel, která jsou v ní seřazena podle své vzrůstající polarity: pentan, hexan, chloroform, ethanol, kyselina octová, voda. Často se však ukazují rozličné směsi těchto rozpouštědel jako vhodnější než samotná čistá rozpouštědla.
U plynové adsorpční chromatografie se jako mobilní fáze (nosný plyn) používá většinou dusík nebo helium (lepší, ale podstatně dražší).
Úkol
Adsorpční chromatografie listových barviv na tenké vrstvě silikagelu – pdf
Rozdělovací chromatografie
Je založena na rozdílné rozpustnosti dělených látek ve dvou různých kapalinách, tedy na rozdílných hodnotách rozdělovacího koeficientu .
Jedna z použitých kapalin je mobilní fází, druhá je potom zakotvena na nějakém nosiči a tvoří tak stacionární fázi. Pokud jsou použité kapaliny vzájemně nemísitelné, stačí obvykle k zakotvení jedné z nich nevazebné interakce s povrchem nosiče. Jinak musíme zakotvit tuto kapalinu chemickou vazbou. U plynových chromatografií je mobilní fází místo kapaliny plyn. Zakotvená kapalina potom musí buď vykazovat minimální těkavost za teplot použitých při separaci (musí mít vysoký bod varu), nebo ji musíme také chemicky na nosič navázat.
Dělené látky, které za daných podmínek vykazují větší poměr mezi svou rozpustností v zakotvené fázi ku rozpustnosti v mobilní fázi, tedy vyšší hodnotu rozdělovacího koeficientu, jsou stacionární fází více zdržovány, „“tráví“ v ní delší čas než látky jiné a mobilní fází jsou tedy unášeny pomaleji. Proto vykazují vyšší eluční časy nebo větší eluční objemy, v plošných technikách potom nižší hodnoty retenčního faktoru.
Pokud je zakotvenou fází voda, hovoříme o tzv. chromatografii s normální fází. Často se však setkáváme se zakotvenými organickými kapalinami s obvykle nízkou polaritou a tehdy hovoříme o tzv. obrácené fázi. Použité kapaliny jsou zakotveny na nosičích nejrůznějšího chemického složení. Patrně nejčastěji se setkáme s nosiči z oxidu křemičitého, skla, rozličných (ko)polymerů, škrobu, celulózy aj.
Mobilní fázi vybíráme z tzv. mixotropní řady rozpouštědel, která jsou v ní seřazena podle své klesající polarity (na rozdíl od eluotropní řady u adsorpční chromatografie): voda, …, kys. octová, … ethanol, … chloroform, … hexan, pentan. I zde se však ukazují rozličné směsi těchto rozpouštědel jako mnohdy vhodnější než samotná čistá rozpouštědla. U plynové rozdělovací chromatografie se jako mobilní fáze (nosný plyn) používá opět dusík či helium.
Ionexová chromatografie
Je založena na coulombickém přitahování opačných nábojů. Stacionární fáze má na svém povrchu chemické skupiny nesoucí náboj. Pokud jsou v protékající mobilní fázi přítomné ionty opačného náboje nebo molekuly silně dipólové, jsou elektrostatickými silami přitaženy a dostatečně pevně zadrženy na povrchu stacionární fáze. Na rozdíl od předchozích dvou druhů chromatografie nejsou obvykle pouze zpomalovány, ale úplně se zastaví. K tomu, abychom je z kolony uvolnili, musíme změnit charakter elučního činidla tak, aby došlo buď k vytěsnění dělených iontů, nebo změně jejich náboje, a to navíc postupně. Interakce iontu či dipólu s ionexem stoupá s jeho nábojem, resp. jeho polaritou a klesá s jeho velikostí, jak ostatně lze dovodit i jen z představy Coulombova zákona.
Materiály používající se jako stacionární fáze v ionexové chromatografii se nazývají ionexy neboli iontoměniče. Ionexy dělíme podle náboje na anexy nesoucí na povrchu kladný náboj a přitahující tak anionty a katexy se skupinami nabitými záporně a přitahující kationty z roztoku.
Nejčastějšími skupinami chemicky vázanými na povrchu anexů jsou (seřazeno podle vzrůstající síly vázající anion): primární aminy –NH2, sekundární aminy –NHR, terciární aminy –NR2 a kvartérní amoniové báze –N+R3.
Na povrchu katexů se potom obvykle setkáváme se skupinami kyselými (opět podle vzrůstající síly vázající kation): fenolická skupina –OH, karboxylová skupina –COOH, fosfátová skupina –PO(OH)2 a sulfátová skupina –SO3H.
Vlastní skelet ionexu je buď organický (např. dextrany, celulóza, kopolymery styrenu a divinylbenzenu), nebo anorganický (zeolity, fosforečnany, molybdenany, fosfomolybdenany, aj.).
Mobilní fází bývají skoro bez výjimky vodné roztoky, ať už se jedná o roztok vzorku nebo o eluční činidlo. Jak bylo již výše řečeno, ionty ze vzorku jsou obvykle ionexem pevně připoutány a nakonec je nutno uvolnit je. K tomu slouží dva typy eluce: vytěsněním a změnou náboje (přenábojováním). V obojím případě, abychom jednotlivé složky z původního vzorku eluovali postupně, a tak je od sebe oddělili, používáme gradientové eluce. To znamená, že s časem měníme složení elučního roztoku.
Při eluci vytěsněním využíváme výše zmíněného faktu, že síla elektrostatické vazby mezi iontem a ionexem klesá s velikostí iontu. Malé ionty (např. Na+ nebo Cl-) v dostatečné koncentraci jsou proto schopny vytěsnit ionty větší (např. ionty aminokyselin). Při eluci vytěsněním tak postupně zvyšujeme iontovou sílu elučního roztoku přicházejícího na kolonu.
Eluci změnou náboje (přenábojováním) můžeme uplatnit tehdy, když námi dělené látky jsou amfoterní a změnou pH mění i svůj náboj. Příkladem může být ionexové dělení směsi aminokyselin nebo bílkovin. Při dostatečně vysokém pH se na anexu zachytí všechny námi požadované složky ve formě aniontů. Eluujeme roztokem, jehož pH postupně klesá. Klesne-li pH v koloně na hodnotu izoelektrického bodu (pI) jedné ze složek, ta ztratí svůj náboj, coulombické síly se prakticky zruší a eluční roztok ji strhne s sebou. Při dalším poklesu pH ona složka dostane záporný náboj a je od povrchu anexu dokonce odpuzována. Později pH klesne k hodnotě pI další složky a ta se stejným způsobem eluuje z kolony za tou první. Toto se potom může opakovat pro další složky původní směsi a my jsme tak schopni je od sebe oddělit. Je zřejmé, že jednotlivé složky se eluují v pořadí hodnot svých izoelektrických bodů (ve výše uvedeném příkladu v pořadí klesajícím).
Gelová permeační chromatografie
Je metoda separace (frakcionace) založená na rozdílné průchodnosti částic dělené směsi stacionární fází v závislosti na jejich velikosti.
Stacionární fáze je tvořena malými kuličkami, ve kterých je spousta „tunýlků“ a „jeskyněk“ o různé velikosti.
Některá složka dělené směsi však může mít tak velké částice, že se do žádné ze zmíněných prohlubenin nevejde, a tak má možnost pouze obtékat kuličky dělicího materiálu a protékat škvírami mezi nimi. Proto má při unášení mobilní fází k dispozici vlastně nejmenší prostor a je tak unášena nejrychleji.
Jiná složka může mít částice takové velikosti, že se již vejdou alespoň do některých otvůrků v kuličkách dělicího materiálu. Tak mají tyto částice při průtoku k dispozici nejen prostor okolo kuliček, ale i prostor prohlubenin dostatečné velikosti, kam mohou volně difundovat. Tím je jejich rychlost (při konstantním průtoku mobilní fáze, samozřejmě) o něco pomalejší než u velkých částic té první uvažované složky.
Konečně můžeme mít složku, jejíž částice jsou tak malé, že mají pro svůj pohyb k dispozici prostor všech otvůrků v kuličkách dělicího materiálu. Tato složka se proto bude ve směru průtoku mobilní fáze pohybovat nejpomaleji.
V konečném efektu tak teoreticky z chromatografické kolony vyteče jako první složka s největšími částicemi a jako poslední složka s nejmenšími částicemi. Proto slouží gelová permeační chromatografie pro dělení směsí vysokomolekulárních látek (hlavně bílkovin) podle jejich molekulových hmotností.
Nezbytnou podmínkou ale je, aby materiál dělicího média byl ke všem děleným složkám zcela inertní a specificky nezadržoval žádnou z nich.
Chceme-li rozdělit nějakou směs co nejlépe, musíme vybrat stacionární fázi s co nejvhodnějším rozsahem velikosti otvůrků. Takový výběr proto záleží na předpokládaném rozsahu velikosti (molekulové hmotnosti) složek dělené směsi. Naštěstí máme k dispozici velmi široké spektrum komerčních materiálů a běžně tak můžeme dělit směsi relativně nízkomolekulárních látek o molekulové hmotnosti řádu tisíců až desetitisíců daltonů i směsi velmi vysokomolekulárních látek s molekulovou hmotností statisíců až milionu.
Podle polarity stacionární a mobilní fáze rozlišujeme systémy hydrofilní a hydrofobní. V naprosté většině se však setkáváme s těmi prvními, tedy se systémy hydrofilními, a mezi nimi zcela převažuje systém polysacharidových skeletů stacionární fáze a vodných roztoků jako mobilní fáze.
Gelové permeační chromatografii se někdy říká nesprávně molekulární filtrace nebo filtrace na molekulových sítech. Jak vyplývá ze skutečné podstaty gelové permeační chromatografie, jsou to názvy zavádějící, protože se o žádnou filtraci nejedná.
Afinitní chromatografie
Je založena na specifických interakcích obvykle nevazebné povahy. Jeden z partnerů se pevně chemicky naváže jako ligand na vhodný nosič a tvoří tak spolu s ním stacionární fázi. Druhý z partnerů je obsažen ve vzorku a za vhodných podmínek je na koloně specificky navázán nevazebnými interakcemi právě na onen ligand. Po důkladném promytí kolony vhodným roztokem (např. fyziologickým apod.) pro odstranění všech složek nespecificky (a tedy velmi slabě) zadržených na koloně se námi požadovaná látka eluuje vhodně vybraným roztokem – elučním činidlem.
Pro řadu vhodných systémů lze příslušnou stacionární fázi i s již navázaným ligandem zakoupit, neboť je komerčně dostupná. Ty nedostupné (nebo pro dané pracoviště příliš drahé) lze připravit laboratorně. Vhodný nosič se nejprve chemicky aktivuje a prolitím roztoku ligandu takto zaktivovaným nosičem se připraví vlastní sorbent. Ten je po důkladném promytí a deaktivaci zbytků reaktivních skupin připraven k izolaci příslušné složky ze vzorku. Nejčastějším typem nosičů jsou gely polysacharidové a ty se aktivují např. bromkyanem CNBr. Na nosiči aktivací vzniklé nitrilové skupiny pak reagují snadno s –OH nebo –NH2 skupinami ligandu za vzniku klasických kovalentních vazeb.
Elučními činidly bývají nejčastěji pufry o nízkém nebo naopak vysokém pH. Takové kyselé nebo zásadité prostředí totiž změní konformaci a případně i náboj izolované složky a/nebo ligandu, čímž dojde ke zrušení původních nevazebných interakcí a izolovaná složka je tak unášena mobilní fází z kolony ven. Po izolaci stačí ke zpětné rekonstituci ligandu na koloně i izolované složky obvykle jen jejich převedení do pufru o vhodném „fyziologickém“ pH. Jiné možnosti eluce – tedy eluce vytěsněním kompetitivním ligandem nebo kompetitivní substancí – se mj. pro nutnost složité zpětné rekonstituce používají jen velmi zřídka.
Afinitní chromatografie je použitelná např. pro soustavy antigen-protilátka, lektin-glykoprotein, enzym-substrát, receptor-hormon, imunoglobuliny-protein A nebo G, albuminy-Blue Sepharose apod.
Sloupcová kapalinová chromatografie
Dělicí médium – stacionární fáze – je umístěno ve skleněných nebo kovových trubicích, v tzv. chromatografických kolonách. Horním koncem kolony vstřikujeme vzorek a přivádíme tam případný promývací roztok a samozřejmě i eluční činidlo. Pokud protéká eluční roztok jen díky gravitaci, hovoříme o tzv. nízkotlaké kolonové chromatografii. Pokud roztoky nutíme protékat kolonou za zvýšeného tlaku za použití čerpadel (pump), hovoříme o vysokotlaké chromatografii. Potom lze použít daleko jemnější materiál stacionární fáze a kolony se stávají pro dělení podstatně účinnější, s vyšším počtem teoretických pater (u adsorpční nebo rozdělovací chromatografie), a kapacitnější díky většímu povrchu stacionární fáze.
Plošná kapalinová chromatografie
Stacionární fáze je ve formě volné vrstvičky. Buď je to nějaký práškový materiál na inertní podložce u tenkovrstvých chromatografií, nebo je to samotný chromatografický papír (obdoba filtračních papírů) u papírové chromatografie. Tenkovrstvá chromatografie se dosud občas používá pro orientační analýzy vzorků nebo pro preparaci frakcí před další analytickou metodou (např. pro oddělení mastných kyselin z biologického materiálu před jejich podrobnou analýzou plynovou chromatografií). U analytického použití je vrstvička stacionární fáze opravdu tenká, obvykle méně než 1 mm. Pro preparace však musí být vrstva podstatně silnější, až do cca 1 cm, aby obsáhla větší množství vzorku. Papírová chromatografie byla kdysi velmi rozšířenou chromatografickou metodou, dnes se však s ní v praxi už nejspíše nesetkáme.
Mobilní fázi, tzv. vyvíjecí činidlo, přivádíme na dělicí médium při plošných chromatografiích buď zespodu – tzv. vzestupné uspořádání, obvyklé u tenkovrstvých chromatografií, nebo shora – tzv. sestupné uspořádání, obvyklé u papírové chromatografie. V uspořádání vzestupném je hnací silou mobilní fáze vzlínání, v sestupném se k silám vzlínání přidává ještě gravitace. U obou technik je však nutné, aby veškeré dělicí médium bylo během dělení umístěno v nádobě (např. chromatografické kyvetě) s nasycenými párami použitého vyvíjecího roztoku, aby vlivem odpařování vyvíjecího činidla z relativně velké plochy dělícího média nedocházelo ke značným nerovnoměrnostem toku mobilní fáze, a tak k deformacím zón dělených frakcí.
Poměr vzdálenosti středu koncentračního maxima každé zóny od startu ke vzdálenosti čela mobilní fáze od startu se označuje jako retardační faktor (RF).
Protože existuje značné množství faktorů (např. teplota, malé odchylky ve složení chromatografické soustavy, vlhkost), které do jisté míry ovlivňují polohu zóny, a tedy hodnotu RF, vyvíjíme obvykle na chromatogramu zároveň vzorek standardu (autentické látky). Dosáhne-li standard a látka oddělená z neznámého vzorku stejné hodnoty RF (a to nejméně ve třech různých chromatografických soustavách), je pravděpodobné, že se jedná o látky chemicky totožné. Množství látky v zóně lze odhadnout podle její plochy, kvantitativně stanovit denzitometrem, či po vymytí látky ze zóny vhodným rozpouštědlem.
Úkol
Adsorpční chromatografie listových barviv na tenké vrstvě silikagelu – pdf
Plynové chromatografie
Plynové chromatografie (GC) užívají jako mobilní fázi nějaký – ke vzorku i k stacionární fázi – inertní plyn. Tímto nosným plynem bývá často dusík, výhodnější vlastnosti pro dělení má helium, je však podstatně dražší. Z použití plynu jako mobilní fáze však vyplývá omezení GC: všechny složky vzorku musí být natolik těkavé, aby je bylo možno nejen zplynit před vstupem do kolony, ale aby z té kolony také nakonec odtěkaly a nezůstaly tam natrvalo jako vysokovroucí kondenzát. Pokud je chromatografická kolona tvořena kratší či delší (v tom případě bývá stočena do několika závitů) trubicí s práškovitou náplní stacionární fáze, hovoříme o tzv. náplňové GC. Podle druhu náplně můžeme u této GC uvažovat jak o adsorpční tak i o rozdělovacích. Pokud použijeme kolony většího průměru, může připadat v úvahu i semipreparativní použití, jinak zdaleka převažuje analytické využití.
Klasickou kolonu však také můžeme nahradit dlouhou skleněnou nebo polykarbonátovou kapilárou (řádově desítky metrů, stočenou do mnoha závitů), jejíž vnitřní povrch je potažen velmi tenkou vrstvičkou nějaké organické vysokovroucí kapaliny (např. silikonových olejů apod.). V tom případě hovoříme o tzv. kapilární GC. Z uvedeného plyne, že kapilární GC lze použít jen pro případ rozdělovací chromatografie a jen v analytice. Pro preparace je kolona příliš tenká a vzorek lze proto pro dělení použít v množství řádově μl. Kapilární GC má však při analytickém využití proti náplňové GC jednu obrovskou přednost – mnohem vyšší účinnost dělení a tedy vyšší rozlišovací schopnost.
K dělení složek vzorku a k jejich konečnému opuštění kolony u GC může docházet při stále stejné teplotě a jde tedy o izotermní eluci. Častěji, zvláště u složitějších směsí ve vzorku, používáme však gradient teploty. Chromatografii začneme při nižší teplotě a tu pak během času postupně (kontinuálně nebo skoky) zvyšujeme. Proto jsou celé kolony umístěny v termostatovaných a teplotně programovatelných komorách. Maximálně použitelné teploty jsou závislé na vlastnostech stacionární fáze a vzorku a obvykle nepřekračují 300 °C.
Eluční chromatografie
Jednotlivé frakce vzorku, děleného v chromatografické koloně, musíme nějakým způsobem nakonec dostat z kolony ven. Promývání kolony kapalinou (tzv. elučním činidlem) za tímto účelem se říká eluce. Pokud promýváme kolonu elučním činidlem o stále stejném složení, hovoříme o tzv. izokratické eluci. Mnohdy však během eluce musíme složení elučního činidla měnit (např. jeho iontovou sílu, pH, poměr polárních a nepolárních rozpouštědel apod.) a potom hovoříme o tzv. gradientové eluci. K tomu je zapotřebí mít k dispozici nejlépe dvě programovatelné pumpy postupně míchající dva roztoky (výchozí a konečný) v různém poměru nebo pumpu spojenou s míchačkou gradientů, ke které jsou připojeny dva zásobníky rozdílných roztoků.
S vytěsňovací elucí se setkáváme zřídka, nezapočítáme-li sem eluci gradientem iontové síly u ionexové chromatografie nebo eluci vytěsněním kompetitivním ligandem či kompetitivní substancí u afinitní chromatografie, jak je uvedeno výše.
Frontální eluce prakticky připadá v úvahu jen u přípravy tzv. deionizované vody. Při ní protéká destilovaná nebo vodovodní voda kolonou s anexem a katexem, přičemž jsou z ní danými ionexy vychytávány všechny odpovídající ionty. Elučním činidlem je zde vlastně „vzorek“ samotný, tedy čištěná voda. Deionizovanou vodu tak touto frontální elucí získáváme do té doby, než se vyčerpá kapacita použitých ionexů.
Analytická chromatografie
Slouží k identifikaci a kvantifikaci jednotlivých složek zkoumané směsi a pracuje obecně s velmi malým množstvím vzorku.
Preparativní chromatografie
Má za úkol jednotlivé složky směsi od sebe rozdělit v dostatečném (tzv. važitelném) množství, aby bylo možno je dále zpracovávat a využít. Proto je množství vzorku obvykle podstatně větší než u analytické chromatografie. Tomu musí odpovídat i velikost a kapacita použitých chromatografických kolon při provedení na koloně, resp. tloušťka tzv. tenké vrstvy u tenkovrstevné chromatografie.
Detekční techniky používané v chromatografii
Chromatografie jsou vždy spojeny s určitou detekční technikou založené na principu:
- Absorpční spektrofotometrie
- fluorescenční spektrofotometrie
- Coulometrie
- Amperometrie
- Konduktometrie
- Hmotnostní spektrometrie
U kolonových/kapilárních technik jsou eluované analyty detekovány kontinuálně měřením některé jejich měřitelné fyzikálně-chemické vlastnosti (např. absorbance, fluorescence, redoxního potenciálu, vodivosti). Signál detektoru bývá zpracováván počítačovým programem, který slouží i k vyhodnocování separace. Signál z detektoru v závislosti na čase dává tzv. chromatogram – časový záznam charakterizující danou směs složek. Jednotlivé vrcholy chromatogramu odpovídají jednotlivým složkám ve zkoumané směsi. Množství daného analytu odpovídá ploše/výšce pod eluční křivkou (píkem).
- Detektory používané u kolonových kapalinových technik
- UV-VIS spektrofotometry
- DAD spektrofotometry (Diode Array Detector)
- Fluorimetry
- Coulometry
- Amperometry
- Konduktormetry
- Refraktometry
- Radiometry
- Polarimetry
- Detektory používané u plynové chromatografie
- Teplotně vodivostní (TCD)
- Plamenoionizační (FID)
- Termoionizační (TID)
- Heliový ionizační (HeD)
- Elektronového záchytu (ECD)
- Hmotnostně spektrometrické (MS)
U plošných chromatografií, pokud zde nebyly použity radioaktivní látky, lze skvrny jen obtížně kvantifikovat. Proto se plošné chromatografie používají víceméně jen pro kvalitativní analýzu.
Nebyly-li dělené složky samy barevné nebo luminiscenční, musíme je obvykle zviditelnit barevnou chemickou reakcí. Někdy stačí zahřátí tenké vrstvy na vyšší teplotu, kdy dojde oxidací ke vzniku barevné látky nebo až k zuhelnatění rozdělených látek, většinou však využíváme detekčních činidel. Pro organické látky je to např. žlutý roztok kyseliny fosfomolybdenové, který se s většinou z nich při zahřátí zbarví do modra až do černa (redukce Mo6+ na MoO2).
Komerčně dostupné jsou také tenké vrstvy, které v sobě obsahují fluorescenční barvivo citlivé na UV světlo o vhodné vlnové délce. Pokud jsou ve vzorku látky absorbující tuto vlnovou délku, při ozáření UV světlem stíní ono fluorescenční barvivo a to se projeví tmavšími skvrnami na svítící tenké vrstvě. Např. na Silufolu UV 254 jsou takto detekovatelné všechny aromatické sloučeniny a řada sloučenin s násobnými konjugovanými vazbami.