Spektrofotometrie
V řadě stanovení v biochemii se využívá skutečnosti, že mnoho látek pohlcuje elektromagnetické záření ve viditelné nebo ultrafialové části spektra, méně často infračervené záření. Míra, jakou látka pohlcuje světlo různých vlnových délek (tj. absorpční spektrum) závisí na struktuře sloučeniny. Množství světla určité vlnové délky, které pohltí např. látka rozpuštěná v roztoku, závisí na koncentraci látky. Měření absorpce světla vzorkem patří mezi nejpoužívanější techniky v biochemii a označuje se jako fotometrie (pokud se měří při jedné nebo několika konkrétních vlnových délkách) a spektrofotometrie (pokud se měří v určitém souvislém rozsahu vlnových délek světla).
Barevnost látek
Řada látek obsahuje valenční elektron, který může být excitován do vyšší energetické hladiny elektromagnetickým zářením. Taková látka pak absorbuje záření o určité vlnové délce s energií fotonů odpovídající rozdílu energií obou elektronových hladin. Pokud absorbované záření leží ve viditelné části spektra, bude se lidskému oku látka jevit barevná (bude mít barvu doplňkovou k barvě absorbovaného světla).
| Absorbovaná vlnová délka (nm) | Odpovídající barva | Doplňková barva | ||
|---|---|---|---|---|
| 380–435 | fialová | žlutozelená | ||
| 435–480 | modrá | žlutá | ||
| 480–490 | zelenomodrá | oranžová | ||
| 490–500 | modrozelená | červená | ||
| 500–560 | zelená | purpurová | ||
| 560–580 | žlutozelená | fialová | ||
| 580–595 | žlutá | modrá | ||
| 595–650 | oranžová | zelenomodrá | ||
| 650–760 | červená | modrozelená |
Předpovědět barvu látky na základě její chemické struktury bohužel není jednoduché, ani není možné na základě absorpčního spektra jednoznačně usuzovat na složení látky. Z našeho hlediska jsou však významné tři skupiny látek, které jsou často barevné:
- Látky obsahující systém konjugovaných dvojných vazeb, jejichž molekula není symetrická. Představíme-li si symetrický konjugovaný systém dvojných vazeb, může existovat ve dvou rezonančních stavech, které jsou energeticky rovnocenné: Přítomnost asymetrického substituentu způsobí, že se energie obou stavů budou lišit. Rozdíl energií přitom často odpovídá energii fotonu z viditelné části spektra. Typickými zástupci mohou být barviva s polymethinovým řetězcem (–CH=CH–CH=CH–) nebo azobarviva (–N=N–). Podobně se chovají i látky s aromatickými či heterocyklickými strukturami vázanými na společný centrální atom (např. trifenylmetanová barviva).
- Rovněž d a f valenční elektrony mnohdy podmiňují barvu sloučeniny. Bývají přítomny v koordinačně kovalentních vazbách komplexních sloučenin. Například bezvodý síran měďnatý CuSO4 je bezbarvý, zatímco jeho pentahydrát CuSO4•5H2O i vodný roztok mají modrou barvu: v obou případech totiž měď vstupuje do komplexu s vodou [Cu(H2O)4]2+. Podobně bývají barevné i komplexní sloučeniny dalších přechodných kovů (Fe, Cu, Cr, Mn, Ni, Co), komplexně vázaný kov je i v barevných bílkovinách hemoglobinu a cytochromech.
- Barevné jsou také ionty, které jako centrální atom obsahují přechodný kov s vysokým oxidačním číslem, např. MnO4-, Cr2O72-.
Analytické metody používané v lékařské chemii a biochemii využívají všech tří skupin barevných sloučenin. Systémy konjugovaných dvojných vazeb často vznikají v reakcích, v nichž analyt kondenzuje s vhodným chromogenem (např. kreatinin s kyselinou pikrovou v Jaffého reakci, diazokopulační reakce při průkazu bilirubinu), nebo vznikají oxidací chromogenu, který obsahuje o jednu dvojnou vazbu méně (oxidace derivátů benzidinu v peroxidázových reakcích). Tvorby barevných komplexů se využívá např. při stanovení bílkovin tzv. biuretovou reakcí (komplexy Cu2+ s O a N peptidových vazeb) nebo při průkazech řady látek např. pomocí FeCl3. Změny barvy při redukci Cr6+ na Cr3+ se využívá např. při průkazu ethanolu ve vydechovaném vzduchu.
Absorpce monochromatického světla může být podmíněna i jinými ději, než je excitace elektronu. Jde především o změny různých oscilačních energií atomů v molekulách a rotačních energií celých molekul. Tyto principy se využívají spíše ve fluorimetrii. Z hlediska lékařské biochemie jsou mnohem méně významné než výše uvedené principy.
Základní veličiny a vztahy používané ve spektrofotometrii
Transmitance
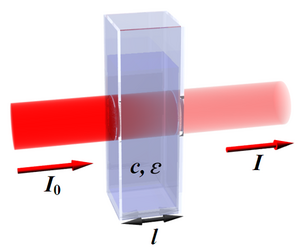
Množství světla určité vlnové délky, které prošlo vzorkem, popisuje veličina transmitance (lat. transmitto převádím, propouštím). Ta je definována
kde
- T je transmitance,
- I je intenzita světla, které prošlo vzorkem,
- I0 je intenzita světla, které do vzorku vstoupilo.
V praxi by bylo nevhodné měřit přesně obě intenzity: kromě vlastností vzorku jsou ovlivněny i absorpcí a odrazem světla na stěnách kyvety a v optice fotometru, prostředím, v němž probíhá měření atd. Proto se obvykle měří transmitance relativně vzhledem ke slepému vzorku. Nejprve se změří intenzita světla procházejícího slepým vzorkem (blankem, referenčním vzorkem), tj. roztokem obsahujícím všechny složky vyjma stanovované barevné látky. Pak se za stejných podmínek měří intenzita světla procházejícího neznámým vzorkem. Transmitance je pak definována vztahem
kde
- T je transmitance,
- Iv je intenzita světla, které prošlo vzorkem,
- Ib je intenzita světla, které prošlo slepým vzorkem.
Měří-li se transmitance tímto způsobem, není třeba se zabývat nespecifickými ztrátami intenzity světla. Intenzita světla, které prochází slepým vzorkem, se považuje za 100 % (tj. transmitance blanku je 100 %) a transmitance vzorků absorbujících světlo dané vlnové délky je vždy menší než 100 %.
Transmitance roztoku, který obsahuje barevnou látku, záleží na
- vlastnostech absorbující látky,
- vlnové délce procházejícího světla,
- množství absorbující látky, tj. na její koncentraci v roztoku a na tloušťce kyvety.
August Beer (1825–1863) poprvé formuloval závislost transmitance na těchto veličinách matematicky. Za předpokladu, že se použije monochromatické světlo, platí
kde
- T je transmitance,
- ε je molární dekadický absorpční koeficient (konstanta specifická pro danou látku při určité vlnové délce),
- l je optická délka kyvety,
- c je látková koncentrace absorbující látky.
Algebraickými úpravami můžeme transmitanci vyjádřit také
nebo ,
na základě čehož se definuje absorbance a optická hustota
Absorbance
Absorbance je veličina používaná ve fotometrii a spektrofotometrii. Udává, kolik světla bylo pohlceno měřeným vzorkem. V literatuře se můžeme setkat i se starším termínem extinkce E.
Absorbanci můžeme definovat na základě transmitance jako:
- kde:
- A je absorbance;
- T je transmitance téhož vzorku za stejných podmínek.
Z definice transmitance vyplývají pro absorbanci vztahy:
V homogenním prostředí je měřená absorbance (A) úměrná optické délke kyvety (l), kterou záření prochází a koncentraci absorbující látky v roztoku (c) podle vztahu:
- ε je molární dekadický absorpční koeficient (konstanta specifická pro danou látku při určité vlnové délce)
- l je optická délka kyvety,
- c je látková koncentrace absorbující látky.
Poslední vztah se označuje jako Lambertův-Beerův zákon (Johann Heinrich Lambert, 1728–1777). Praktickou výhodou jeho užití je, že absorbance je přímo úměrná koncentraci absorbující látky.
Z výše uvedených rovnic je zřejmé, že nulovou absorbanci bude mít vzorek, který nepohltí žádné světlo, absorbance 1 znamená, že vzorkem prošla právě jedna desetina světla, při absorbanci 2 právě jedna setina vstupujícího světla atd. Záporná absorbance by znamenala, že vzorkem prochází více světla než slepým vzorkem, zpravidla v důsledku hrubé chyby nebo nesprávného uspořádání pokusu.
Absorbance je bezrozměrná veličina.
Spektrofotometr
Pro měření veličin jako absorbance a transmitance, ale někdy např. i turbidance, se používají fotometry a spektrofotometry. Zařízení, která měří při jedné nebo jen několika přesně definovaných vlnových délkách monochromatického světla, označujeme jako fotometry. Technicky složitější a dokonalejší přístroje, které umožňují vlnovou délku monochromatického světla libovolně nastavit, nebo měřit část absorpčního spektra v určitém úseku vlnových délek, se nazývají spektrofotometry.
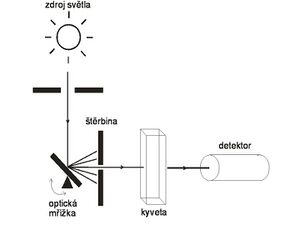
Uspořádání fotometru
Principiálně se fotometr i spektrofotometr skládá ze čtyř částí:
- zdroj světla
- monochromátor
- oddíl, ve kterém je umístěn vzorek
- detektor
Zdroj světla
Jako zdroj světla slouží vhodná Žárovka nebo výbojka. Žárovky a halogenové žárovky poskytují záření o spojitém spektru ve viditelné a infračervené oblasti, nelze je však použít pro měření v UV oblasti. Jako zdroje ultrafialového záření se používají nejčastěji vodíková nebo deuteriová výbojka. Zdrojem UV i viditelného světla může být také např. xenonová výbojka, široký rozsah vlnových délek je však vyvážen některými nevýhodami: její světlo je složením spojitého a čárového spektra, takže jsou velké rozdíly mezi intenzitami při různých vlnových délkách, výbojka je velmi drahá a intenzita jejího světla není příliš stabilní.
Monochromátor
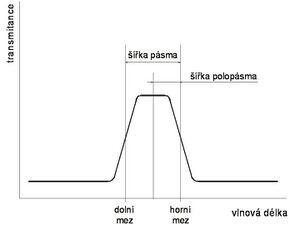
Polychromatické světlo následně prochází monochromátorem. Nejjednodušší a nejlevnější možností je zařazení vhodného interferenčního filtru do optické dráhy. Komerčně dostupné jsou dnes filtry prakticky pro libovolnou vlnovou délku ultrafialové a viditelné oblasti. Rozlišuje se několik druhů filtrů, jejichž vhodnou kombinací se sestaví filtr požadovaných vlastností. Low-pass filtry propouštějí světlo vlnových délek kratších, než je určitá mez (cut-off). High-pass filtry naopak propouštějí jen světlo, které má větší vlnovou délku, než je hraniční vlnová délka filtru. Pásmové filtry propouštějí určitý rozsah vlnových délek. Protože hranice nebývají zcela ostré, uvádí se jako dolní a horní mez zpravidla taková vlnová délka, pro kterou má filtr padesátiprocentní transmitanci ve srovnání s vlnovou délkou, kterou propouští nejlépe. Někdy se také uvádí střední vlnová délka, kterou filtr propouští, a šířka pásma (nebo polopásma).
Obvykle dnes jako monochromátor slouží optická mřížka, jejímž nakláněním lze plynule měnit vlnovou délku (např. tzv. Czerného-Turnerův monochromátor). Rozsah vlnových délek, které z monochromátoru vycházejí, určuje štěrbina, buď pevně nastavená, nebo rovněž nastavitelná. Čím je štěrbina širší, tím větší je intenzita vycházejícího světla, ovšem za cenu menší specifičnosti měření. Naopak užší štěrbina zajistí přesnější dodržení požadované vlnové délky, ovšem za cenu menší intenzity světla a zhoršení odstupu signálu od šumu.
Vzorek
Monochromatické světlo prochází vzorkem. Většinou se pracuje s roztoky, které se plní do standardních kyvet s optickou dráhou 1 cm. Kyvety se v přístroji umisťují do kyvetátoru, který zajišťuje jejich přesnou polohu, může být temperován a někdy obsahuje i magnetickou míchačku, pomocí níž lze po vložení míchadélka do kyvety promíchávat její obsah během měření. Často bývá možné do kyvetátoru založit najednou několik kyvet, které se pak automaticky vsunují do optické dráhy.
Detektor
Světlo vycházející ze vzorku konečně dopadá na detektor, zpravidla fotodiodu nebo jiný fotoelektrický prvek. Intenzita se vyhodnotí pomocí systému převodníků, srovná se s intenzitou světla procházejícího slepým vzorkem, a tím se získá absorbance. Přesnost měření ovlivňuje integrační čas – doba, po kterou se absorbance měří. Čím je delší, tím přesnější bude výsledek měření, pokud ovšem není absorbující látka fotocitlivá (tj. pokud nedojde při delším osvitu k vyblednutí vzorku). Nevýhodou dlouhého integračního času je samozřejmě také prodlužování doby měření, což je podstatné zejména při zpracování velkého množství vzorků, při měření při velkém počtu vlnových délek (tj. při měření spekter), nebo při zpracování vzorků, které se v čase mění (kinetická měření).
Kromě tzv. jednopaprskových fotometrů, v nichž se nejprve měří slepý vzorek a pak se do stejné optické dráhy vkládá měřený vzorek, se používají i tzv. dvoupaprskové fotometry, které jsou vybaveny dvěma detektory a umožňují měřit slepý i měřený vzorek současně ve dvou optických drahách.
Jiná uspořádání spektrofotometru
Měření spektra na spektrofotometru s optickou mřížkou znamená, že přístroj změří absorbanci při jedné vlnové délce, pak posune mřížku, měří při další vlnové délce a to se neustále opakuje, dokud se neproměří celá požadovaná oblast. To s sebou přináší poměrně dlouhou dobu měření, což může být na závadu z několika důvodů:
- vzorek se může v čase měnit (zejména při kinetických měřeních)
- vzorek může být fotocitlivý, v průběhu měření dochází k jeho vyblednutí
- pokud se zpracovává více vzorků, které nejsou dostatečně stabilní, může být technicky obtížné zajistit stejné podmínky pro první a poslední vzorky
- měření trvá dlouho, výkonnost metody je nízká
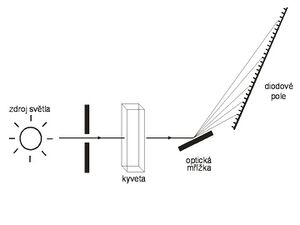
Diodové pole
Uvedené nedostatky odstraňuje jiné uspořádání spektrofotometru, měření pomocí diodového pole (diode-array). Při něm prochází vzorkem bílé světlo, které je až poté rozloženo na jednotlivé vlnové délky (zpravidla pomocí pevně postavené optické mřížky) a dopadá na destičku s velkým množstvím detektorů – fotodiod (odtud název diodové pole). Diodové pole je přitom umístěno tak, že na každou fotodiodu dopadá určitý (poměrně úzký – např. 2 nm) rozsah vlnových délek. Zařízení neobsahuje žádné pohyblivé prvky, což zvyšuje reproducibilitu měření, a navíc se změří celé spektrum najednou. Doba měření se tak může zkrátit z několika minut na zlomky sekundy. Toto uspořádání navíc umožňuje konstruovat přístroje přibližně o řád přesnější, než klasické fotometry, navíc nevyžadující prakticky žádnou údržbu, kalibraci atd. Zásadní nevýhodou bývá mnohonásobně vyšší pořizovací cena, avšak se zlevňováním miniaturních elektronických prvků se náklady na výrobu diodového pole rychle snižují.
Fotomerie se svislým paprskem
V rutinním použití má klasické uspořádání fotometrie i další nevýhody:
- vyžaduje velké množství vzorku
- má malou výkonnost, zpracování jednotlivých vzorků je pracné
- kyvety jsou drahé a náročné na údržbu
- spektrofotometry jsou nákladné
Tyto nevýhody z velké části odstraňuje měření v mikrotitračních destičkách pomocí fotometru se svislým paprskem (čtečka destiček, plate reader). Vzorky se plní do polystyrenových destiček s 96 jamkami, existují ale i jiné formáty (od 4 do 384 jamek). Pro práci s mikrotitračními deskami jsou k dispozici speciální pomůcky (vícekanálové pipety, opakovací pipety atd.), které výrazně urychlují přípravu vzorků. Na rozdíl od klasických fotometrů, v nichž se absorbance měří vodorovným paprskem a optická dráha je daná tloušťkou kyvety, probíhá v tomto případě měření pomocí svislého paprsku a délka optické dráhy záleží na výšce hladiny v jamce. Pokud ke vzorku přidáme určité množství bezbarvého roztoku, sníží se sice koncentrace absorbující látky, zároveň se ale úměrně zvýší hladina roztoku v jamce (prodlouží se optická dráha) a výsledná absorbance bude stejná. Naopak, pokud se ze vzorku odpaří část bezbarvého rozpouštědla, optická dráha se sice zkrátí, zato však stoupne koncentrace absorbující látky a absorbance se opět nezmění. Lze říci, že na rozdíl od klasické fotometrie, kde absorbance odpovídá koncentraci absorbující látky v roztoku, závisí absorbance při měření svislým paprskem na látkovém množství absorbující látky ve vzorku. Pro fotometrii svislým paprskem je třeba mnohem menší objem vzorku – jamky se zpravidla plní jen 100 až 300 μl roztoku. Mikrotitrační destičky jsou jednorázové a jsou vzhledem k počtu zároveň měřených vzorků podstatně levnější než plastové kyvety. Změření všech 96 jamek trvá obvykle jen několik vteřin. Rovněž destičkové fotometry bývají poměrně levné, jako monochromátor většinou používají sadu interferenčních filtrů. Zvláště často se fotometrie svislým paprskem využívá v imunochemii, zejména v metodice ELISA (odtud rozšířené označení přístroje ELISA-reader). Pro větší přehlednost se při fotometrii svislým paprskem kromě pojmu absorbance používá ještě termínu optická hustota (OD – z anglického optical density). Platí přitom vztah
- kde je optická hustota, je absorbance a je délka optické dráhy.
Optická denzita tedy závisí jen na vlastnostech vzorku, nikoli však na délce optické dráhy, po níž světlo vzorkem prochází.
Reflexní fotometrie
Jinou fotometrickou technikou je reflexní fotometrie – technika rutinně používaná například v klinické biochemii v rámci tzv. suché chemie. V suché chemii se biologický materiál nezpracovává obvyklým způsobem ve zkumavkách či jiných nádobkách, ale nanese se na film napuštěný jednotlivými složkami reakční směsi. Výsledkem je změna barvy políčka, kterou lze kvantifikovat pomocí reflexního fotometru – měří se úbytek světla určité vlnové délky odraženého od políčka. Jako zdroj světla se používají buď LED diody emitující vhodnou vlnovou délku, nebo žárovkové zdroje s interferenčními filtry. Pro zvýšení citlivosti se odražené světlo soustřeďuje na detektor vydutým zrcadlem (tzv. Ulbrichtovou koulí). Klasickým příkladem suché chemie a reflexní fotometrie je vyšetření moči pomocí diagnostických proužků, vzhledem k jednoduchosti a rychlosti při přesnosti srovnatelné s klasickými metodami se však množství aplikací rychle rozšiřuje.
Pokročilé spektrofotometrické techniky
Multikomponentní analýza
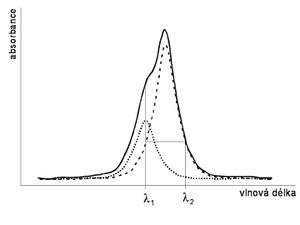
Často se stává, že v části spektra, kde má absorpční maximum stanovovaná látka, zároveň absorbuje i další složka reakční směsi. V tom případě nelze snadno stanovit koncentraci měřené látky, protože absorbance při zvolené vlnové délce je součtem absorbancí obou látek. Pokud je koncentrace druhé, „překážející“ složky známá, nebo pokud lze experiment uspořádat tak, aby byla konstantní ve všech vzorcích, lze tuto situaci vyřešit pomocí vhodných slepých vzorků. V některých případech je však nutné postupovat metodami tzv. multikomponentní analýzy spektra.
Obvykle se neměří při jedné vlnové délce, ale proměřuje se určitá spojitá část spektra, nebo se přinejmenším měří při několika vlnových délkách. Jsou-li známé extinkční koeficienty jednotlivých látek absorbujících v dané oblasti při různých vlnových délkách (nebo ještě lépe, jsou-li známá absorpční spektra jednotlivých složek směsi), lze koncentraci analytu vypočítat řešením soustavy rovnic.
V nejjednodušším případě je třeba stanovit koncentraci jedné látky, přičemž její absorpční spektrum (na obrázku tečkovaně) překrývá spektrum jiné ve vzorku přítomné látky (čárkovaně). Měřením vzorku získáme spektrum, které je součtem obou absorpčních spekter (plnou čarou). I když víme, že stanovovaná látka má absorpční maximum při vlnové délce , nemůžeme stanovit její koncentraci přímo, neboť při této vlnové délce nelze zanedbat absorbanci druhé látky. Známe-li však tvar absorpčního spektra druhé látky, můžeme najít vlnovou délku, při které absorbuje stejně, jako při vlnové délce (označme ji ), tj. extinkční koeficient je pro a stejný. Potom absorbance samotné stanovované látky bude
Využití isosbestického bodu
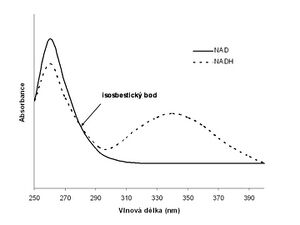
Pokud látka, která má určité spektrum, se v průběhu nějaké reakce mění na jinou látku, která má jiné spektrum, ale obě spektra se částečně překrývají. Příkladem mohou být spektra NAD+ a NADH (stanovení těchto koenzymů se využívá při měření aktivity řady enzymů pomocí tzv. Warburgova optického testu). V tomto případě jsou absorpční maxima dostatečně daleko od sebe, takže stanovení jednotlivých forem koenzymu je jednoduché. Užitečná však může být skutečnost, že všechna spektra pro různé poměry NAD+/NADPH (při konstantní celkové koncentraci) se kříží. To je způsobeno tím, že při vlnové délce 281 nm má NAD+ i NADH stejný extinkční koeficient. Průsečík spekter se nazývá isosbestický bod (z řeckého ισος isos = stejný a σβεννυμι sbennými = zháším) a měřením absorbance v tomto bodě snadno zjistíme celkovou koncentraci NAD+ a NADH, aniž bychom potřebovali znát aktuální poměr koncentrací obou složek.
Další metody
Řadu dalších dat lze získat vhodným matematickým zpracováním naměřených spekter. Při měření složitějších soustav může pomoci derivační spektrofotometrie, která umožní po vyhodnocení prvních a druhých derivací spekter podle vlnové délky např. najít přesné polohy absorpčních maxim apod. Rovněž pro zpracování kinetických měření je nezbytné matematické zpracování získaných dat.
Přesnost fotometrických metod
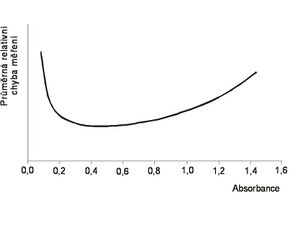
Většina fotometrů může měřit absorbanci v rozmezí 0 až 3 nebo 4. To však neznamená, že by měření v celém tomto rozsahu bylo rozumné. Za předpokladu, že náhodná chyba detektoru bude mít stále stejné vlastnosti, bude mít průměrná relativní chyba měření absorbance v závislosti na skutečné absorbanci vzorku průběh ve tvaru písmene U. Nejlepších výsledků dosáhneme, bude-li se absorbance vzorku pohybovat v rozmezí 0,2 až 0,8, za rozumné lze považovat měření v rozsahu 0,2 až 1,2. Je-li absorbance vyšší, je vhodné vzorek ředit. Konkrétní hodnoty samozřejmě závisejí na vlastnostech použitého fotometru, ovšem průběh průměrné relativní chyby jako funkce absorbance bude stále stejný (liší se jen „roztažení“ křivky).
Přesnost měření je velmi ovlivněna i přípravou vzorku a kyvety. Uveďme aspoň nejvýznamnější vlivy, které ovlivňují přesnost spektrofotometrických stanovení:
- je třeba měřit ve vhodné kyvetě, zvolená vlnová délka musí ležet v pásmu, pro které je kyveta určena
- měří-li se ve více kyvetách, měly by mít všechny stejný faktor. Plastové kyvety by měly být všechny ze stejné šarže.
- kyvety pro vzorky i blanky musejí být čisté. To lze ověřit tak, že naplněné destilovanou vodou dají všechny stejnou absorbanci.
- s kyvetami je třeba pracovat tak, aby nedošlo ke znečištění optických ploch (např. dotykem prstů). Totéž platí i pro mikrotitrační destičky.
- kyveta musí být zvenčí suchá, uvnitř nesmějí zůstat bublinky vzduchu, měřený roztok musí být homogenní. Kapka stékající po kyvetě, bublinky nebo plovoucí sraženina v měřeném roztoku se projeví obvykle tím, že se naměřená absorbance neustále mění.
- kyveta musí být vzorkem dostatečně naplněná.
- měří-li se více vzorků postupně v jedné kyvetě, je třeba pracovat tak, aby chyba způsobená zbytky předchozího roztoku byla co nejmenší. Obvykle se kyveta mezi vzorky vyplachuje destilovanou vodou a pak se co nejlépe vysuší. Přesnějších výsledků dosáhneme, pokud se kyveta po vymytí ještě propláchne malým množstvím vzorku, který se vylije a pak teprve se kyveta naplní potřebným množstvím vzorku pro měření. Pokud se pracuje s několika podobnými roztoky, může být přesnější kyvety mezi nimi neproplachovat destilovanou vodou, jen je co nejlépe vylít a vysušit.
- při měření v kyvetách je podstatná koncentrace barevné látky v roztoku, při přípravě vzorku je proto nejdůležitější dodržet poměr jednotlivých složek. Je vhodné uspořádat pokus tak, aby se všechny složky pipetovaly pokud možno stejnou pipetou, nejlépe pevně nastavenou.
- Měří-li se v mikrotitračních destičkách, je naopak rozhodující látkové množství barevné látky ve vzorku. Proto je třeba pokus uspořádat tak, aby byl do jamky co nejpřesněji odměřen analyt. Velkou chybu může také způsobit různý tvar hladiny v jednotlivých jamkách, všechny vzorky by proto měly mít stejnou afinitu ke stěnám destičky, případně je vhodné desku před měřením krátce promíchat, aby se zajistilo smočení stěn i nad hladinou roztoku.
Kyveta
Kyveta je laboratorní pomůcka pro měření optických vlastností roztoků. Nejčastěji se používají standardní kyvety s optickou dráhou 1 cm (vzácněji kratší – tzv. ultramikrokyvety pro velmi malé objemy měřených roztoků). Kyvety mohou být vyrobeny z různých materiálů a mohou mít různé provedení.
Materiál kyvety
Kyvety z optického skla (zpravidla označované OG = optical glass, G = glass apod.) se hodí pro měření ve viditelné části spektra. Pro měření v UV oblasti je třeba použít kyvet z křemenného skla (Q = quartz, UV). Dostupné jsou i kyvety ze speciálních optických skel (např. OS = Optisches Glas), které lze obvykle použít pro širší část spektra než kyvety z obvyklého optického skla, jsou však levnější než kyvety křemenné. Měření v kyvetách z různých typů skla je velmi přesné, při správné technice lze stanovit absorbanci vzorku s přesností až na čtyři či pět desetinných míst. Kyvety jsou však relativně drahé – z optického skla stojí řádově stovky až tisíce korun, cena běžné kyvety z křemenného skla se pohybuje kolem čtyř až pěti tisíc korun. Přitom je životnost kyvet omezená, navíc jejich údržba je poměrně pracná. Z těchto důvodů se pro běžná měření používají jednorázové plastové kyvety, jejichž cena bývá jen několik korun, na druhou stranu s nimi lze spolehlivě měřit s přesností jen na dvě až tři desetinná místa (což je však pro většinu aplikací plně vyhovující). Většinou se vyrábějí z polystyrenu (PS) – pro viditelnou část spektra, nebo z polymetylmetakrylátu (PMMA) – i pro část UV oblasti.
Rozměry kyvety
Standardní spektrofotometrické kyvety (tzv. makrokyvety) mají dnes vnitřní rozměry 1×1×3 až 4 cm a plní se na objem 3 ml (nebo méně podle uspořádání fotometru a výšky paprsku nade dnem kyvety). Vzhledem k tomu, že se pracuje se stále menšími vzorky, používají se čím dál častěji semimikrokyvety, které mají prostor pro vzorek zúžený a stačí je tak plnit jen asi 0,8 ml vzorku (opět záleží na provedení přístroje). Dostupné jsou i mikro- a ultramikrokyvety, které (někdy již za cenu zkrácení optické délky) mohou pracovat i s podstatně menšími objemy (řádově až mikrolitry). Protože by při použití semimikro-, mikro- a ultramikrokyvet v některých spektrofotometrech podstatná část světla procházela sklem kolem vzorku, což by výrazně zvyšovalo pozadí a zhoršovalo přesnost měření, bývají tyto kyvety tzv. maskované – sklo kolem oblasti se vzorkem je začerněno. Na někerých kyvetách bývá uveden tzv. faktor kyvety – vlastně skutečná optická délka kyvety v cm. V ideálním případě je faktor kyvety roven jedné, může se však lišit v důsledku výrobních nepřesností.
Speciální kyvety
Pro speciální aplikace se používají další typy kyvet, např. průtokové kyvety, které lze připojit např. k chromatografickým přístrojům, temperované kyvety, spektrofotometrické kapiláry apod.
Odkazy
Související články
Externí odkazy
Převzato z
Použitá literatura
Reference