Gibbsova energie
(přesměrováno z Gibbsova volná energie)
Gibbsova energie (též volná entalpie, Gibbsova volná energie, Gibbsova funkce či Gibbsův potenciál) je stavová veličina, obvykle značená písmenem , představující tu část tepelného obsahu soustavy, kterou je možno využít k přeměně na jinou formu energie. Zbytek tepelného obsahu soustavy se může přeměnit pouze na teplo. Její jednotkou v soustavě SI je joule (J).
Důvodem pro její zavedení bylo to, že entropie jako kritérium samovolnosti děje se hodí pouze pro adiabatické děje. Nově zavedený termodynamický potenciál - Gibbsova volná energie, představuje kritérium vhodné pro obecnější podmínky (pro izotermicko - izobarické děje).
Gibbsovu energii (v soustavě s neměnným počtem částic) můžeme vyjádřit pomocí jiných stavových veličin vztahem:
- ,
kde je entalpie, je termodynamická teplota (K) a je entropie. Gibbsova energie je také stavovou veličinou. Z daného vztahu vyplývá, že čím menší je hodnota entropie, tím větším množstvím Gibbsovy volné energie soustava disponuje.
Živé organismy tedy získávají nejvíce využitelné energie ze strukturně složitých sloučenin jako jsou polysacharidy, bílkoviny a lipidy, které mají nízkou hodnotu entropie. Naopak při syntéze těchto sloučenin se velké množství energie spotřebovává.
Pomocí Gibbsovy energie lze definovat chemický potenciál.

Chemické děje[upravit | editovat zdroj]
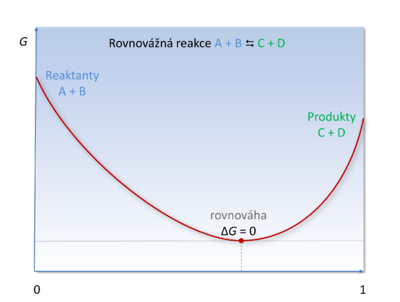
Při chemických přeměnách se mění obsah Gibbsovy energie mezi počátečním stavem G1 a konečným stavem G2 soustavy:
Mohou nastat tři situace:
a) a tedy
V tomto případě je Gibbsova energie produktů menší než Gibbsova energie substrátů, energie se uvolňuje a jedná se tedy o děj exergonický. Tato energie může být dále přeměněna na práci či jiný druh energie, v buňce např. k biosyntéze ATP. V organismu tato situace nastává v případě katabolických reakcí, při kterých dochází k degradaci složitých sloučenin a uvolňování energie.
b) a tedy
Gibbsova energie produktů má vyšší hodnotu než energie substrátů, jedná se tedy o reakci endergonickou, při které musíme energii soustavě dodat. Typicky je tato reakce spražena s nějakou "víc" exergonickou reakcí, takže celková Gibbsova energie této složené soustavy klesá. V organismu probíhají děje anabolické, při kterých se syntetizují složité struktury, či aktivní transport látek přes buněčnou membránu.
c)
V tomto případě nedochází ke změně energetického obsahu soustavy, systém je v rovnováze.
Odkazy[upravit | editovat zdroj]
Související články[upravit | editovat zdroj]
Externí odkazy[upravit | editovat zdroj]
- Co je Gibbsova energie? článek na serveru Česká chemie.cz
- Gibbsova energie, RNDr. Martin Bojkovský, 2009
- Článek o Gibbsově energii v německé Wikipedii
Použitá literatura[upravit | editovat zdroj]
- MATOUŠ, Bohuslav, et al. Základy lékařské chemie a biochemie. 1. vydání. Praha : Galén, 2010. 540 s. ISBN 978-80-7262-702-8.
- KOLEKTIV, Autorů. Gibbs free energy [online]. [cit. 2014-12-08]. <https://en.wikipedia.org/wiki/Gibbs_free_energy>.
- BOJKOVSKÝ, Martin. Gibbsova energie [online]. [cit. 2014-12-08]. <http://fikus.omska.cz/~bojkovsm/termodynamika/gibbsova_energie.html>.