Růstový hormon (sekrece)
(přesměrováno z Inzulínu podobné růstové faktory)
Řízení sekrece hypothalamem[upravit | editovat zdroj]
Sekrece STH je řízena dvěma hypothalamickými hormony, které jsou secernovány do portální hypofyzární krve:
- GHRH (STH-RH, GRH, somatoliberin) – působí stimulačně.
- Somatostatin (GHIH) – působí inhibičně.
Protože nelze přímo měřit ani GRH ani somatostatin, je nutné považovat změnu v sekreci STH za projev součtu obou těchto hypothalamických hormonů. Kromě této regulace se na regulaci sekrece STH podílí řada dalších faktorů (viz dále).
GHRH[upravit | editovat zdroj]
GRH stimuluje syntézu i sekreci STH v somatotropech adenohypofýzy (tvorbou cAMP). V lidském hypothalamu je přítomen GRH o 40 i o 44 aminokyselinách. Neurony secernující GRH jsou lokalizovány v nuclei arcuati a jejich axony končí v zevní vrstvě eminentia medialis. GRH se syntetizuje z většího prekurzoru o 107 nebo 108 aminokyselinách (liší se přítomností, resp. nepřítomností serinu na pozici 103). Lidský GRH se silně podobá mnohým gastrointestinálním peptidům, včetně sekretinu, gastrinu, vasoaktivního intestinálního peptidu (VIP) a žaludečního inhibičního peptidu. Poločas GRH je 50 min. Podání GRH vede k rychlé sekreci STH (během minut), vrcholu dosáhne po 30 minutách a účinek přetrvává 60–120 minut.
Somatostatin[upravit | editovat zdroj]
Somatostatin inhibuje sekreci STH (snižuje tvorbu cAMP v somatotropech) i TSH (tím, že zvyšuje přímý inhibiční účinek thyroidálních hormonů na adenohypofyzární thyreotropy). Buňky secernující somatostatin se nachází v periventrikulární oblasti hypothalamu bezprostředně nad optickým chiasmatem a jejich nervová zakončení jsou difuzně v zevní vrstvě eminentia medialis. Somatostatin je tetradekapeptid a kromě hypothalamu je také v D-buňkách Langerhansových ostrůvků pankreatu, v gastrointestinální sliznici a v parafolikulárních buňkách (C-buňky) štítné žlázy. Prekurzor somatostatinu má 116 aminokyselin. V hypothalamu je hlavní somatostatin-14, ve střevě je somatostatin-28. Somatostatin má též silné inhibiční účinky na další hormony, včetně insulinu a glukagonu (parakrinně v Langerhansových ostrůvkách), gastrinu, sekretinu a VIP (v gastrointestinální sliznici). Sekrece somatostatinu se zvyšuje při zvýšené hladině STH a IGF-I (viz dále). Dlouhopůsobící syntetický analog somatostatinu (oktreotidacetát) se využívá v terapii (pro stavy nadbytku STH).
Nárazová sekrece[upravit | editovat zdroj]
STH se do krve vyplavuje v pulzech. Tato nepravidelná, intermitentní sekrece je spojená se spánkem a závisí na věku. Vrcholu dosahuje za 1–4 hodiny po usnutí (během spánkových fází 3 a 4). Tyto noční sekreční pulzy činí asi 70 % celkového množství secernovaného za den a jsou vyšší u dětí, s věkem se snižují. Sekrece GRH je epizodická a její zvýšení koreluje s navýšením sekrece STH. Sekrece somatostatinu je spíše tonická.
Inzulinu podobné růstové faktory[upravit | editovat zdroj]
Účinek růstového hormonu je zprostředkován především insulinu podobnými růstovými faktory (IGF-I a IGF-II) (STH má ale také některé přímé účinky – cestou cAMP). IGF-I (původně somatomedin C) a IGF-II (původně somatomedin A) jsou hlavními a u lidí pravděpodobně jedinými somatomediny v krvi. Oba mají strukturu podobnou proinsulinové molekule a oba se váží na proteiny plazmy (což prodlužuje jejich poločas v krvi). Do současnosti bylo identifikováno šest IGF-vazebných bílkovin (IGFBP), které jsou různě distribuovány v různých tkáních. Všechny jsou přítomny v plazmě. Asi 95 % IGF cirkuluje v krvi ve vazbě na IGFBP-3, jehož hladina v séru je přímo úměrná koncentraci STH a nutričnímu stavu organismu. Nedostatek STH způsobuje nižší koncentrace IGF-I i IGF-II, ale nadbytek STH zvyšuje IGF-I aniž by ovlivnil IGF-II.
IGF-I[upravit | editovat zdroj]
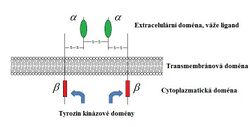
Jediný gen pro prepro- IGF-I je lokalizovaný na dlouhém raménku chromozomu 12. IGF-I je bázický polypeptid o 70 aminokyselinách. Jeho receptor (receptor typu I) se nachází na buněčné membráně a podobá se inzulinovému receptoru (dva alfa a dva beta řetězce). Vazbou IGF-I na receptory typu I dojde ke stimulaci tyrosinkinázy a následné autofosforylaci tyrosinových molekul, což vede k buněčné diferenciaci nebo dělení (příp. k obojímu). IGF-I receptory jsou „down-regulovány“ při zvýšené koncentraci IGF-I. Naopak snížené koncentrace IGF-I vedou k zmnožení IGF-I receptorů. Nejdůležitějším místem pro syntézu IGF-I jsou játra (ale je produkován i jinými orgány, např. chrupavkou). Zdá se, že se předává sousedícím buňkám, které ovlivňuje parakrinním působením (příp. je autokrinním faktorem, který ovlivňuje buňku, ze níž pochází), v krvi tak nemusí mít největší účinky.
- Účinky IGF-I
- zvyšuje zabudovávání sulfátu (SO4)2- do chrupavek a tím stimuluje jejich růst,
- stimulační vliv na hematopoezu,
- stimulační vliv na tvorbu ovariálních steroidů, proliferaci a diferenciaci myoblastů,
- diferenciace oční čočky.
- potlačuje sekreci STH a stimuluje sekreci somatostatinu.
Před narozením sekrece IGF-I na růstovém hormonu nezávisí (viz dále), po narození je však stimulována STH a IGF-I má výrazný stimulační účinek na růst. Koncentrace IGF-I v krvi stoupá v dětství a vrcholí v době puberty, pak klesá až k nízkým hodnotám ve stáří. IGF-I se v současnosti vyrábí rekombinantní DNA technologií. Podávání IGF-I zvyšuje retenci dusíku a snižuje dusík močoviny v krvi a stimuluje růst u STH resistentních pacientů (Laronův nanismus).
IGF-II[upravit | editovat zdroj]
IGF-II je neutrální peptid skládající se z 67 aminokyselin. Gen pro prepro-IGF-II je lokalizován na krátkém raménku chromozomu 11 (v blízkosti genu pro preproinsulin) a u dospělých se exprimuje jen v chorioidálním plexu a v meningách. Receptor typu II přednostně váže IGF-II a je totožný s manózo-6-fosfátovým receptorem, což je transmembránová bílkovina s jediným řetězcem. Většina účinků IGF-II se zdá být zprostředkována interakcí s receptorem typu I, byly popsány i nezávislé účinky IGF-II prostřednictvím receptoru typu II. IGF-II je na STH převážně nezávislý a má význam při růstu fétu před narozením.
Další faktory regulující sekreci STH[upravit | editovat zdroj]
Vedle GRH a somatostatinu regulují sekreci STH další faktory:
- Stimulační
- hypoglykémie (např. podání 2-deoxyglukózy, která způsobí intracelulární deficit glukózy, se zvýší sekrece STH),
- příjem potravy s vysokým podílem proteinů, ale také proteínokalorická malnutrice (vede ke snížení tvorby IGF-I a tím k odpadnutí negativní zpětné vazby),
- intravenózní infuze aminokyselin (např. argininu), hladovění (díky tomu dojde k mobilizaci tuků jako zdroje energie a šetření proteinů),
- tělesná námaha, stres, dopaminergní a α-adrenergní agonisté.
Pohlavní hormony, především estrogeny, a ß-adrenergní antagonisté zvyšují reakce STH na stimulační podněty (jako jsou arginin, inzulin).
- Snižující hladinu
Perorální či intravenózní podání glukózy snižuje hladinu STH (využítí v diagnostickém testu akromegalie). Mastné kyseliny potlačují reakce STH na některé sekreční podněty, jako jsou arginin a hypoglykemie. Také nadbytek kortizolu a hypo- i hyperthyreózea snižují odpověď růstového hormonu na sekreční podněty. Sekreci STH inhibují ß-adrenergní agonisté a dopaminergní antagonisté.
Odkazy[upravit | editovat zdroj]
Související články[upravit | editovat zdroj]
Externí odkazy[upravit | editovat zdroj]
Zdroj[upravit | editovat zdroj]
Se svolením autorky Kláry Mědílkové
Použitá literatura[upravit | editovat zdroj]
- GREENSPAN, F. S a J.D BAXTER. Základní a klinická endokrinologie. 1. vydání. H+H, 2003. ISBN 80-86022-56-0.
- GANONG, William F. Přehled lékařské fyziologieb. 20. vydání. Galén, 2005. ISBN 80-7262-311-7.
- TROJAN, Stanislav. Přehled lékařské fyziologie. 4. vydání. Grada, 2003. ISBN 80-247-0512-5.
- BLAHOŠ, J a O BLEHA. Endokrinologie. 1. vydání. 1979.
- KYTNAROVÁ, J, B ZLATOHLÁVKOVÁ a M FEDOROVÁ. Intrauterinní růstová retardace a fetální původ chorob v dospělosti. Česko-slovenská pediatrie. 2008, roč. 63, no. 6, s. 320-326, ISSN 1803-6597.
- POMAHAČOVÁ, R. Léčba růstovým hormonem v dětském věku. Farmakoterapie. 2007, roč. 6, no. 5, s. 501-506, ISSN 1803-6597.