Liposomy a řízené uvolňování léčiv
| Samostatná práce | ||||
| Tento článek je editován studenty 2. LF UK v rámci plnění jejich studijních povinností (seminární práce – vypracování zkouškových otázek z biofyziky). Ostatní uživatele prosíme, nezasahujte výrazněji do jeho tvorby až do doby, než bude práce odevzdána (s výjimkou malých editací – opravy překlepů, pomoci s formátováním apod.). Máte-li nějaké náměty či připomínky, uveďte je prosím v diskusi. V případě potřeby kontaktujte autory stránky – naleznete je v historii. | ||||
| Stránka byla naposledy aktualizována v sobotu 28. 6. 2025 v 21.48. | ||||
Liposomy jsou slibnými a hojně využívanými přenašeči bioaktivních látek a léčiv díky schopnosti biodegradace, nízké toxicitě spojené s nízkým výskytem vedlejších účinků a možnosti transportovat hydrofilní, hydrofobní i amfifilní látky. Nevýhodou je poměrně krátká životnost těchto částic v krevním oběhu (tj. cca 200 minut) a také nekontrolovatelné uvolňování nesených léčiv.
Modifikace povrchu liposomů[upravit | editovat zdroj]
Zlepšení vlastností lze dosáhnou různými modifikacemi povrchů liposomů.
Základní způsoby modifikace:
- uzavření liposomální částice s obsahem léčiva do speciálního polymerního obalu, tzv. „scaffolding“
- navázání molekul rozličné povahy přímo na povrch liposomů
„Scaffolding“[upravit | editovat zdroj]
Obecně lze definovat jako využití prostorově propustných biomateriálů sloužící ke zlepšení vlastností nanočástice. Scaffold má za účel obalit nanočástici, proto tento typ povrchové úpravy můžeme nazvat 3D. Používá se pro dopravu proteinů (protein), léků, růstových faktorů a také liposomů v těle. Scaffolding se využívá hlavně ve tkáňovém inženýrství.
Výhodou využití scaffoldů je delší lokální zachování látky, pomalejší uvolnění léku a potenciál pro dlouhodobé skladování. Nevýhodou je však nutnost opakované aplikace přípravku a pasivní uvolňování obsahu nanočástice.
Pro tvorbu scaffoldu se používají různé polymery. Mezi jejich důležité vlastnosti se řadí: odbouratelnost (někdy se však používají i syntetické neodbouratelné), nízká imunitní odpověď, netoxičnost, biokompatibilita. Vhodnými polymery splňujícími většinu podmínek jsou jak přírodní tak syntetické látky.
Přírodní polymery jsou:
- proteiny (kolagen, fibrinogen, elastin, keratin, aktin a myosin) - scaffold na bázi kolagenu - kolagen má vynikající vlastnosti, je to přírodní polymer vyskytující se v těle člověka. 3D scaffolding na bázi kolagenu se používá v genovém inženýrství a dalších oborech,
- polysacharidy (celulóza, amylóza, dextran, chitin a glykosaminoglykany),
- polynukleotidy (DNA, RNA).
Syntetické polymery jsou:
- polyvinyl alkohol, deriváty kyseliny polyakrylové (carbopol) [1] a další.
Typy liposomů podle modifikace povrchové vrstvy[upravit | editovat zdroj]
- Konvenční liposomy – v membráně obsahují převážně jen fosfolipidy, kvůli čemuž jsou poměrně nestabilní; mají taktéž poměrně nízkou transportní kapacitu a vysokou propustnost. Membránu je možno obohatit o cholesterol, který vede ke stabilizaci a prodloužení životnosti částic v krevním oběhu (až na 1000 minut). Jsou základem pro výrobu většiny dalších typů povrchově modifikovaných liposomů.
- Dlouhodobě cirkulující liposomy – také se vyskytují pod názvy „long-circulating“ nebo „stealth“. V membráně obsahují dlouhý řetězec hydrofilního polymeru (nejčastěji polyethylenglykolu, PEG), který na povrchu částice vytvoří jakýsi obal zabraňující spuštění nežádoucí imunitní reakce.
- Aktivní liposomy – odvozují se od dlouhodobě cirkulujících liposomů. K uvolňování léčiv dochází selektivně a kontrolovaně, k aktivaci je zapotřebí stimul.
- „Targeted“ liposomes – ve své struktuře obsahují antigeny, protilátky, enzymy, proteiny nebo receptory pro afinitní reakci. Afinitní reakce nastane při kontaktu s cílovou oblastí, dojde k akumulaci liposomů a postupnému uvolnění transportované aktivní látky.
- „Triggered“ liposomes – v membráně liposomu je zabudována chemická látka způsobující strukturální změny při působení spouštěcího mechanizmu. Mezi základní typy stimulů patří: fyzikální (teplotní gradient, tlak, působení světla), fyzikálně-chemické (bobtnání, solvatace), iontové (změna koncentrace iontů, změna pH), enzymatické (hydrolýza) a kombinované. [2]
- Lipoplexy – tzv. „charged liposomes“, obsahují kladně nabité fosfolipidy. Dochází k jejich kovalentní interakci s opačně nabitými makromolekulami (DNA, RNA a proteiny). Pro možnost přepravy DNA jsou hojně využívány v genovém inženýrství, rovněž mají potenciál pro léčbu rakoviny, srpkovité anémie, cystické fibrózy, hemofilie a jiných genetických onemocnění.
Naplňování léčivy[upravit | editovat zdroj]
V klinické praxi jsou široce užívána léčiva s malými hydrofilními molekulami i přesto, že léčba pomocí nich je nezřídka kdy spojena s řadou komplikací a vedlejších účinků, např. nízkou intracelulární absorpcí, cytotoxicitou, rychlým vyloučením z organismu či suboptimální biodistribucí.[3]
Těmto problémům lze do jisté míry předejít, jestliže při přepravě účinné látky k cílové tkáni použijeme liposom. Liposomy jsou uměle připravené sférické váčky tvořené lipidovou dvojvrstvou. Na svém povrchu mají specifické ligandy, značky či lipidové řetězce, díky nimž je zprostředkována vazba na receptory buněk.
Díky selektivní propustnosti membrány liposomu je enkapsulovaná látka chráněna před vlivem iontů a velkých molekul s dipólem (sacharidy, proteiny). Další nespornou výhodou liposomu je jeho biokompatibilita s organismem pacienta a možnost regulace uvolňování účinné látky[4]
Liposomy mohou být využity k léčbě celé řady onemocnění. Úspěšnost zvoleného léčebného postupu však nezávisí jen na podání určité léčivé látky, ale i na vybrané metodě přípravy liposomů.
Příprava liposomu[upravit | editovat zdroj]
Parametry při volbě postupu[upravit | editovat zdroj]
- vlastnosti materiálu, kterým má být liposom naplněn, a jejich možná interakce s lipidovou membránou
- vlivy vnitřního prostředí, kterým budou vesikuly vystaveny
- účinná koncentrace zachycené látky a její cytotoxicita
- další procesy, které probíhají v organismu při aplikaci liposomálních léčiv
- optimální velikost a trvanlivost vesikuly. [5]
Liposomy jsou schopny přenášet nejen hydrofilní ale i hydrofobní látky. Podle afinity přenášeného materiálu k vodě se pak liší způsob přípravy liposomu.
Naplnění hydrofilní látkou[upravit | editovat zdroj]
Příprava liposomu s hydrofilní náplní probíhá pomocí tzv. film method, což znamená, že je nejprve připravena lipidová dvojvrstva, ze které jsou poté vytvořeny sférické útvary naplněné účinnou látkou.
- V prvním kroku je tedy nutné za pomoci organického rozpouštědla namíchat homogenní roztok lipidů. Rozpouštědlem je v tomto kroku čistý chloroform či jeho směs s methanolem.[6]
- K této směsi je na některých pracovištích přidáván polysorbát 80, který zde plní funkci emulgátoru a v poslední fázi přípravy zvyšuje účinnost enkapsulace, a dále cholesterol, který je v organismu nedílnou součástí biologických membrán, neboť zvyšuje jejich pružnost.
- Jakmile jsou lipidy rozpuštěny, je třeba ze směsi chloroform odstranit, což lze při menších objemech rozpouštědla (< 1 ml) provést v digestoři proudem suchého dusíku nebo argonu. Větší objemy rozpouštědla se odstraňují v rotačním výparníku při teplotě 50 °C. I po této proceduře však v získaném lipidovém filmu zůstává malé množství chloroformu. Zbytkové rozpouštědlo se odstraňuje důkladným vysušením a zmražením. [6]
- Následně je získaný film hydratován fosfátovým pufrem fyziologického roztoku o pH 6,5 a plněn účinnou látkou. Produktem hydratace jsou multilamelární vesikuly se strukturou podobnou cibuli. Jednotlivé vrstvy jsou elektrostaticky nabité a díky tomu dochází k jejich vzájemnému odpuzování, což je pro jejich budoucí využití nežádoucí. Proto jsou vzniklé liposomy v závěrečné fázi jejich výroby sonifikovány, tzn. za pomoci ultrazvuku zmenšeny a upraveny na unilamelární útvary. V dnešní době je však ultrazvuk je považován za poněkud zastaralou metodu, protože při jeho aplikaci může dojít k poškození struktury léčiva. Z tohoto důvodu je při výrobě léčiv upřednostňována Mozafariho metoda či metoda vytlačování, která je vůči léčivým látkám šetrnější.
Naplnění hydrofobní látkou[upravit | editovat zdroj]
Jak již bylo zmíněno výše, liposomy mohou přenášet i hydrofobní látky. Tento přenos je však specifický v tom směru, že tyto látky musí být zavzaty do lipidové dvojvrstvy. Z tohoto faktu se pak odvíjí i odlišnosti při výrobě.
Aplikace liposomů jako léčiv[upravit | editovat zdroj]
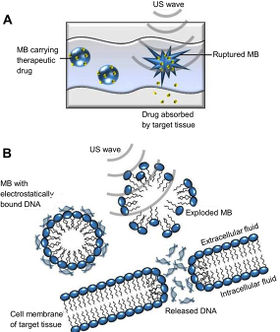
Navzdory odlišnostem při výrobě, aplikace liposomů je v různých případech velmi podobná. Perorální podání takovýchto léčiv by nemělo příliš velkou účinnost, neboť liposomy jsou velmi málo odolné vůči nízkému pH v žaludku, enzymům gastrointestinálního traktu a solím žlučových kyselin. Z tohoto důvodu jsou aplikována parenterálně či topicky. V organismu pak membrána liposomu splývá s membránou cílové buňky a dochází k vylití liposomálního obsahu do buňky[4] (viz obrázek).
Ačkoliv na trh již byla uvedena léčiva využívající liposomy jako nosiči účinné látky, více než půl století po jejich objevení stále probíhají intenzivní výzkumy v oblasti cílené orgánové distribuce a snahy o vyrobení takového liposomu, který by účinnou látku uvolňoval až na základě určitého stimulu a byl využitelný v klinické praxi.[3]
Otevírání liposomů[upravit | editovat zdroj]
Z hlediska aplikace enkapsulovaných (obsažených) látek je velmi důležitý proces degradace (destabilizace) fosfolipidové membrány. To vede buď k úplně destrukci samotného liposomu, nebo se v membráně pouze vytvoří otvor. Následně pak dochází k uvolnění enkapsulované látky.
Důležité je, aby docházelo k degradaci liposomů na,,správném místě“. Pokud například obsahují léčiva, nesmí k destabilizaci fosfolipidové membrány dojít před dosažením cíle. Kdyby k uvolnění docházelo předčasně, snižovalo by to účinnost terapie, nebo by mohlo dojít i k intoxikaci organismu. Pokud jsou liposomy využity jako vektory pro plazmidovou DNA, musí zůstat stabilní až do překonání jaderné membrány.
Otevírací spouštěcí mechanismy[upravit | editovat zdroj]
Spouštěcích mechanismů pro otevírání liposomů je mnoho, nejčastější je například:
- změna pH,
- změna redoxního potenciálu,
- chemické změny vyvolané účinkem nejrůznějších enzymů.
Velká pozornost je věnována především liposomům, které jsou citlivé na pH. Začaly se využívat především kvůli tomu, že při velkém množství patologických procesů buňky (např. nádory, záněty) dochází v postižené oblasti ke snížení pH. Tato změna je sice poměrně malá (okolo 0,4 až 0,8 jednotek), byly však navrženy i liposomy, které jsou schopny reagovat i takto nepatrný rozdíl.
Liposomy citlivé na pH často účinkují na principu neutralizace povrchového náboje membrány. Při neutralizaci dochází ke ztrátě náboje,,polární hlavy“ fosfolipidů, což vede ke snížení plochy a následnému kolapsu celé membrány.
Osud liposomů v organismu velmi záleží i na způsobu, jakým byly aplikovány. Například při intravenozní aplikaci dochází k zadržení plícemi. Z nich pak pokračují dále do krevního řečiště.
Otevírání působením ultrazvuku[upravit | editovat zdroj]
Již od poloviny 90. let minulého stol. byly zveřejňovány vědecké studie poukazující na to, že ultrazvuk pomáhá usnadnit transport membránou nepropustných sloučenin do živých buněk. V dnešní době se zkoumají zejména jeho účinky ve spojení s biologickými přenašeči látek, jako jsou např. liposomy.
Otevírání liposomů pomocí ultrazvuku a následné uvolnění léčiv do buněk probíhá na základě procesu zvaného sonoporace. Jedná se o dočasnou permeabilizaci buněčné membrány, která může nastat v důsledku vystavení ultrazvukovému záření. Existují dva mechanismy sonoporace, které mají vztah k různým biofyzikálním procesům. Vědecké studie z posledních let však naznačují, že kromě procesu sonoporace jsou ultrazvukovým působením a následným uvolňováním léčiv spouštěny i jiné biologické mechanismy, jako je např. endocytóza.
Mechanismy podílející se na sonoporaci vyvolané ultrazvukovým zářením[upravit | editovat zdroj]
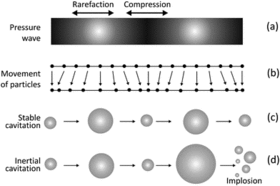
- nekolabující kavitace také známá jako stabilní kavitace (stable cavitation);
biofyzikální aspekty: nekolabující kavitace vzniká při velmi nízkých ultrazvukových intenzitách (při nízkém akustickém tlaku), kdy bubliny oscilují symetricky, lineárně, tzn.že jejich expanze a komprese odpovídá působícímu akustickému tlaku. Při symetrické oscilaci [1] je nárůst objemu plynu během jednoho cyklu expanze/komprese roven 0 (bublina se nezvětšuje). Přijetí léčiv buňkou probíhá v tomto případě dvěma způsoby:
- - tvorbou pórů v buněčné membráně (to je využíváno spíše u malých částic, s malým průměrem). Oscilace uvnitř bublin a jejich vibrující povrch podněcují víření a proudění tekutiny, mikro-proudění, které vyvolává v kapalině v jejich blízkosti smykové napětí. Za předpokladu, že se bubliny nacházejí těsně přilehlé na buněčné membráně, stačí i malá amplituda oscilace, tudíž jsou postačující i nižší ultrazvukové intenzity, k způsobení buněčné porace. Póry průměrně dosahují velikosti od několika desítek až po pár stovek nanometrů. Bubliny však musí být v přímém kontaktu s buňkou. Po přerušení, či vypnutí ultrazvukového záření došlo k znovuzavření pórů v řádu milisekund až sekund, což můžeme chápat tak, že póry existují pouze do té doby, dokud jsou přítomny oscilující bubliny.
- - druhým způsobem je endocytóza (nejčastěji u větších částic; s větším průměrem a vyšší molekulovou hmotností).
- kolabující kavitace , také známá jako přechodná kavitace (inertial cavitation, transient cavitation);
biofyzikální aspekty: kolabující kavitace vzniká při vyšších akustických intenzitách, kdy dochází k zvětšení amplitudy a k jejímu neustálému nárůstu, kvůli zvětšujícímu se objemu bubliny, ta se totiž ve fázi expanze „nafukuje“. Po dosažení velikosti zvané resonanční poloměr bubliny (Rr, bubble resonant radius), se zprudka zvětší a poté drasticky zhroutí, dojde tedy k její implozi [2]. Resonanční poloměr bubliny je dán typem plynu/kapaliny uvnitř bubliny, médiem, ve kterém se bublina nachází, a parametry ultrazvukové vlny. Pro vzduchovou bublinu ve vodě může být resonanční velikost odhadnuta podle rovnice:
| (1) |
kde f je frekvence ultrazvuku (v kHz). Imploze má za následek fragmentaci bubliny do mnoha menších mikrobublinek. Během tohoto rozpadu mohou v okolní kapalině vznikat rázové vlny a silné proudy ("trysky"). Ty vytváří velice výrazné síly, které mohou perforovat buněčnou membránu, pokud se implodující bublina nachází v její blízkosti. [7]
Póry vzniklé působením kolabující kavitace jsou větší, než ty vyvolané stabilní kavitací. Jejich velikost se v průměru pohybuje od stovek nanometrů až po mikrometry, zároveň koreluje s akustickým tlakem: čím vyšší akustický tlak, tím větší amplituda oscilace a větší póry. Tento typ kavitace je tedy vhodný pro transport větších částic. [8]
Ultrazvukové vlny o vysoké intenzitě však představují risk poškození buňky a okolní tkáně, tudíž je nutno postupovat se zvýšenou opatrností. Ukázalo se, že za přítomnosti již vytvořených kavitačních jader, jako jsou například ultrazvuková kontrastní činidla, může být kavitační práh snížen, tím pádem jsou dostačující nižší intenzity ultrazvuku k doručení léčiva nebo genu do buněk, jako jsou například krysí fibroblasty a chondroblasty, lidské rakovinné buňky HeLa, NIH/3T3, C127I, rakovinné buňky prostaty DU145 do tkání jako jsou svaly, játra, plíce, mozek, či nádory. Jako ultrazvuková kontrastní činidla jsou používány malé mikrobubliny plynu kryté surfaktantem (sérový albumin, polymer, fosfolipid)[9].
Bubliny jsou nejčastěji částice plynů (např. polyfluorokarbony), nebo kapalin, které jsou připojeny na léčivem naplněný liposom, či zapouzdřeny uvnitř něj spolu s léčivem.
Zatímco stabilně kavitující bubliny potřebují přímý kontakt s buněčnou membránou, přechodně kavitující bubliny dokáží ovlivnit buněčnou membránu reakcemi, které vyvolávají, i z větší vzdálenosti.
Rozlišujeme tři základní typy ultrazvukového působení, které vyvolávají různé biologické reakce:
- ultrazvuk o nízké intenzitě („low intensity ultrasound“)
- ultrazvuk o vysoké intenzitě („high intensity ultrasound“)
- aplikace ultrazvuku bez přítomnosti mikrobublin
Způsoby degradace[upravit | editovat zdroj]
Degradace vlastních liposomů může proběhnout několika způsoby, avšak přesný sled dějů, které proběhnou po kontaktu s buňkou, zatím stále není objasněn. Známé způsoby průběhu degradace jsou:
- splynutí s buněčnou membránou
- exocytóza
- fagocytóza
- nedostatečná pevnost membrány
První z domnívaných způsobů degradace liposomů je splynutí s buněčnou membránou. V tomto případě dochází k fúzi, což je spojení membrán.
Dále bylo zjištěno, že k degradaci může docházet také tzv. exocytózou, což by v tomto případě znamenalo úplné vyloučení liposomu z intracelulárního prostoru dané buňky, ve které se nacházel.
Fagocytóza je také jednou z možných příčin degradace. Při fagocytóze dojde k pohlcení liposomu jinou buňkou než tou, do které byl cíleně zanesen.
Dalším z faktorů degradace je také nedostatečná pevnost membrány obklopující daný liposom, což následně může vést ke snížení efektivity funkce liposomu díky samovolnému unikání transportované látky. Vědci se domnívají, že tyto samovolné úniky mohou mít dvě vysvětlení. Prvním vysvětlením úniku látky ven z liposomu jsou malé póry ve vlastní membráně obklopující liposom. Druhým vysvětlením je pak únik látky na principu difuze.
Protože zkoumání funkce liposomů patří mezi novější témata, která se teprve prozkoumávají, tak dosud nebyly známy žádné jiné faktory a způsoby, které by vysvětlovaly degradaci liposomů.
Terapeutické aplikace[upravit | editovat zdroj]
Liposomy jsou jedním z unikátních systémů pro podávání léčiv, které mohou být potenciálně použitelné při kontrole a cílení jejich výdeje.[10] Mohou přenášet širokou škálu látek s terapeutickým účinkem, včetně hydrofilních a lipofilních léčiv, oligonukleotidů, bílkovin, peptidů a genů. Dále je možné jejich využití při trombolýze, v léčbe aterosklerózy, v genové terapii nebo při dodávání bioaktivních plynů (xenon, hydrogensulfid, oxid dusnatý, oxid uhelnatý) do tkání.
Kosmetika[upravit | editovat zdroj]
Do málokteré složky kosmetických přípravků bylo vkládáno tolik nadějí jako právě do lipozómů. Dnes jsou obvykle přidávány do gelů i emulzí. Liposomy mohou způsobit zlepšení penetrace (pronikání) kosmetických a medicínských účinných látek. Při svém rozpadu způsobují "zkapalnění" (tzv. fluidizaci) lipidů rohové vrstvy, která se tak stává propustnější. Lipozómy tak působí podobně jako močovina, které se stále častěji a ve vyšších koncentracích v kosmetice využívá jako hydratační faktor. Podle několika průzkumů je však se zlepšenou penetrací spojeny i výrazné negativum, a to že z kosmetických přípravků do pokožky nepronikají pouze účinné látky, nýbrž í látky alergizující - například konzervační látky jako parabeny, alkohol, technické látky včetně stopových zbytků rozpouštědel, katalyzátorů a dalších látek, které se v průběhu chemické výroby mohou v přípravku objevit. Totéž platí i pro veškeré látky z našeho okolí, které se dostanou do kontaktu s pokožkou - původní funkce pokožky ohraničit a vytvořit bariéru proti pronikání okolní světa do lidského organismu je tak narušena.
Hlavní oblastí použití liposomu v kosmetice[upravit | editovat zdroj]
- hydratace
- celulitida
- pajizévky (strie)
- ochrana před účinkem slunečního záření
- péče o vlasy
- tzv. Anti-Aging-přípravky neboli přípravky zpomalující stárnutí (nejen pleti)
Liposomy jako nutriční doplňky stravy[upravit | editovat zdroj]
Použití liposomů bylo až do nedávne doby zaměřeno především na cílené podávání léčiv. Nyní jsou využívány též pro perorální (ústní) aplikaci některých dietních a výživových doplňků. Ve vodě rozpustné vitamíny jsou vstřebávány jen v malém množství (vstřebavání skrze stěnu střeva je závislé na transportních mechanismech) a mají tzv. nízkou biologickou dostupnost. Na rozdíl od toho, zapouzdření do lipozomu nabízí velmi účinnou metodu jak obejít zničení živin v trávícím traktu trávícími enzymy a napomáhá vstřebání živin do buněk a tkání.
Příklad výživových doplňků využívajících lipozomální formu[upravit | editovat zdroj]
- Vitamín C - snižuje oxidační stres, zlepšuje kvalitu vazivových tkání, chrání proti infekci
- Vitamín B - zlepšuje metabolismus nervových buněk
- Glutathion - chrání proti stárnutí, snižuje oxidační stres
Lečení pacientů s atopicky suchou pokožkou[upravit | editovat zdroj]
Atopicky ekzém je doprovázený svěděním a suchou pokožkou. Pacienti mají zvýšenou transmendální ztrátu vody a sníženou schopnost vázání vody. Liposomy vyrobené z epidermálních lipidů by mohly výrazně pomoci s léčbou tohoto onemocnění nahrazením existujících epidermálních lipidů v stratum corneum (nejapikárnější povrh epidermy).
Léčení pacientů s Kaposiovým sarkomem (spojený s HIV virem)[upravit | editovat zdroj]
Léčení liposomální technikou bylo zdaleka více účinější jako léčení metodou spojení bleomycínu a vincristínu (BV). Pacienti kteří dostávali BV léčbu byli spojováni s periferní neuropatií (poškození periferních nervů). Druhá skupina pacientů, která podstoupila léčbu liposomální byla spojována s neutropénii (postihnutí granulocytů, přesnějí velmi nízký počet neutrofilního segmentu v krvi). Výsledkem léčby bylo konstatování, že léčba liposomální technikou byla zdaleka více účinná než léčba BV a také dobře tolerovaná, ale více myelosupresivní (útlm kostní dřene).
Liposomy a rakovina[upravit | editovat zdroj]
Dalši zajímavou vlastností liposomů je jejich přirozená schopnost nazývanou EPR (enhanced permeability and retention effect), díky které jsou schopny zaměřit rakovinu. Tento princip spočívá v tom, že nádor nemůže růst nad určitou velikost bez tvorby nových cév. Díky vysoké rychlosti tvorby cév, jsou „děravé“ a tudíž pro molekuly a částice zpravidla do velikosti 200 nm prostupné. Cévy jinde v těle liposomy do tkání nepropouštějí, nebo jen v omezené míře. Liposom proto může vstoupit do tumoru a začít působit.
Způsob aplikace[upravit | editovat zdroj]
Existují určité typy liposomů, které se podávají perorálně. Obecně však platí, že většina vyráběných lékových forem liposomů není odolná vůči kyselému prostředí žaludku, távicím enzymům i solím žlučových kyselin. Proto častějšími způsoby podání jsou intravenózní, nebo topické.
Perspektiva do budoucnosti[upravit | editovat zdroj]
Existuje široké spektrum chorob, které mají potenciál být v budoucnosti léčené pomocí liposomů (Aid Dementia Complex, tuberkulóza, onkologické onemocnění, nebo neurodegenerativní poruchy jako např. Parkinsonova a Alzheimerova choroba).
Odkazy[upravit | editovat zdroj]
Související články[upravit | editovat zdroj]
Reference[upravit | editovat zdroj]
- ↑ MUFAMADI, Maluta S., Viness PILLAY a Yahya E. CHOONARA. A Review on Composite Liposomal Technologies for Specialized Drug Delivery. Journal of Drug Delivery. 2011, roč. 2011, s. 19, ISSN 2090-3014. DOI: 10.1155/2011/939851.
- ↑ GÓMEZ-HENS, A a J FERNÁNDEZ-ROMERO. Analytical methods for the control of liposomal delivery systems. TrAC Trends in Analytical Chemistry. 2/2006, roč. 25, s. 167–178, ISSN 0165-993. DOI: 10.1016/j.trac.2005.07.006.
- ↑ a b ELOY, Josimar Oliveira, De Souza MARINA CLARO a Raquel PETRILLI. Liposomes as carriers of hydrophilic small molecule drugs: Strategies to enhance encapsulation and delivery. Colloids and Surfaces B: Biointerfaces. 2014, roč. 123, s. 345–363, ISSN 0927-7765. DOI: 10.1016/j.colsurfb.2014.09.029.
- ↑ a b AMLER, Evžen. Nové trendy v aplikaci textilních nosičů v regerenerativní medicíně [přednáška k předmětu Seminář doktorandů, obor Doktorské studium, Fakulta textilní Technická univerzita v Liberci]. Liberec. 2010-11-02. Dostupné také z <http://dirk.kmi.tul.cz/studenti/seminar_doktorandu/seminare_2010-2011/amler_regenerativni_medicina-2010.pdf>.
- ↑ Liposome. Wikipedia: The free encyclopedia [online]. 2014 [cit. 2014-11-22]. Dostupné z:https://en.wikipedia.org/wiki/Liposome
- ↑ a b DUA, J.S., A.C. RANA a A.K. BHANDARI. Liposome: Methods of preparation and applications. International Journal of Pharmaceutical Studies and Research. 2/2012, roč. 3, s. 14-20, ISSN 2229-4619.
- ↑ LENTACKER, I., I. DE COCK a S.C. DE SMEDT. Understanding ultrasound induced sonoporation: Definitions and underlying mechanisms. Advanced Drug Delivery Reviews. 2014, roč. 72, s. 49–64, ISSN 0169-409X. DOI: doi:10.1016/j.addr.2013.11.008.
- ↑ SCHRÖDER, Avi, Joseph KOST a Yecheykel BARENHOLZ. Ultrasound, liposomes, and drug delivery: principles for using ultrasound to control the release of drugs from liposomes. Chemistry and Physics of Lipids. 1-2/2009, roč. 162, s. 1-16, ISSN 0009-3084. DOI: 10.1016/j.chemphyslip.2009.08.003.
- ↑ HUANG, Shao-Ling. Liposomes in ultrasonic drug and gene delivery. Advanced Drug Delivery Reviews. 10/2008, roč. 60, s. 1167–1176, ISSN 0169-409X. DOI: 10.1016/j.addr.2008.03.003.
- ↑ ANWEKAR, Himanshu, Sitasharan PATEL a A. K SINGHAI. Liposome- as drug carrier. International Journal of Pharmacy & Life sciences. 7/2011, roč. 2, s. 945-951, ISSN 0976-7126.
Použitá literatura[upravit | editovat zdroj]
- SCHMID, M.H. a H.C. KORTING. Liposomes for atopic dry skin: the rationale for a promising approach. The clinical investigator. 1993, roč. 8, s. 649-653, ISSN 1432-1440. DOI: 10.1007/BF00184495.
- MUFAMADI, Maluta S., Viness PILLAY a Yahya E. CHOONARA. A Review on Composite Liposomal Technologies for Specialized Drug Delivery. Journal of Drug Delivery. 2010, roč. 2011, s. 1-19, ISSN 2090-3014. DOI: 10.1155/2011/939851.
- GÓMEZ-HENS, A. a J. FERNÁNDEZ-ROMERO. Analytical methods for the control of liposomal delivery systems. TrAC Trends in Analytical Chemistry. 2/2006, roč. 25, s. 167–178, ISSN 0165-993. DOI: 10.1016/j.trac.2005.07.006.
- STEWART, Simon, Helmut JABLONOWSKI a F.D. GOEBEL. Randomized comparative trial of pegylated liposomal doxorubicin versus bleomycin and vincristine in the treatment of AIDS-related Kaposi's sarcoma. International Pegylated Liposomal Doxorubicin Study Group.. Journal of Clinical Oncology. 2/1998, roč. 16, s. 683-691, ISSN 1527-7755.
- Bio-Nano Electronics Research Centre. Polymeric Scaffolds in Tissue Engineering Application: A Review. International Journal of Polymer Science. 7/2011, roč. 2011, s. 1-19, ISSN 1687-9422. DOI: 10.1155/2011/290602.
- KODÍČEK, Milan. Liposomy [online]. [cit. 2014-05-12]. <http://gvm.vm.cz/vyuka/bio_pojmy/hesla/liposomy.html>.
- ŠKRABALOVÁ, Michaela. Kationické liposomy pro transfekci buněk [online]. [cit. 2014-05-12]. <https://is.muni.cz/th/igrd3/DP-_Kationicke_liposomy_pro_transfekci_bunek.txt?so=nx>.
- HAMPL, František. Biomimetika - Organické vrstvy, liposomy [online]. [cit. 2014-05-12]. <http://www.uochb.cas.cz/Zpravy/PostGrad2005/6_Hampl.pdf>.
- POUCHLÝ, Julius. Fyzikální chemie makromolekulárních a koloidních soustav [online]. [cit. 2014-05-12]. <http://147.33.74.135/knihy/uid_isbn-978-80-7080-674-6/pdf/183.pdf>.
- AMLER, Evžen. Nové trendy v regenerativní medicíně [online]. [cit. 2014-05-12]. <http://www.ft.tul.cz/studenti/seminar_doktorandu/seminare_2010-2011/amler_regenerativni_medicina-2010.pdf>.
- SCHRÖDER, Avi, Joseph KOST a Yecheykel BARENHOLZ. Ultrasound, liposomes, and drug delivery: principles for using ultrasound to control the release of drugs from liposomes. Chemistry and Physics of Lipids. 1-2/2009, roč. 162, s. 1-16, ISSN 0009-3084. DOI: 10.1016/j.chemphyslip.2009.08.003.
- SCOTT, Robert C., Deborah CRABBE a Barbara KRYNSKA. Aiming for the heart: targeted delivery of drugs to diseased cardiac tissue. Expert Opinion on Drug Delivery. 4/2008, roč. 5, s. 459-470, ISSN 1744-7593. DOI: 10.1517/17425247.5.4.459.
- DHANDAYUTHAPANI, Brahatheeswaran, Yasuhiko YOSHIDA a Toru MAEKAWA. Polymeric Scaffolds in Tissue Engineering Application: A Review. International Journal of Polymer Science. 2011, roč. 2011, s. 1-19, ISSN 1687-9422. DOI: 10.1155/2011/290602.
- ANWEKAR, Himanshu, Sitasharan PATEL a A. K SINGHAI. Liposome- as drug carrier. International Journal of Pharmacy & Life sciences. 7/2011, roč. 2, s. 945-951, ISSN 0976-7126.
- MILOSLAVA RABIŠKOVÁ. Nanočástice pro lékové formy. 2007.