Poruchy signalizace apoptózy v nádorových buňkách
Jednou ze základních funkcí apoptózy je zabránění zhoubnému bujení tkání. Apoptóza je součástí tkáňové homeostázy – vyvážený vznik i zánik buněk. Nadměrná apoptóza vede k hypotrofii tkáně (např. u ischemie). Snížený zánik (stejně jako zvýšená replikace buněk) vede k nádorové transformaci. Všechny transformované buňky musely během své transformace potlačit apoptózu.
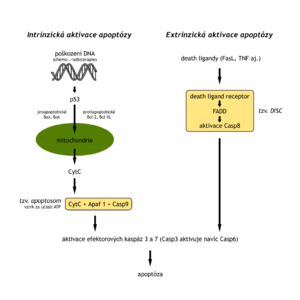
Apoptóza je spouštěna dvěma způsoby – vnitřní a vnější dráhou. V některých buňkách musí být aktivovány obě (zejména zevní, která aktivuje následně tu vnitřní), v jiných stačí pouze vnitřní. Obě dráhy se sejdou aktivováním exekutivních kaspas 3, 7 a 6 a pak proběhne apoptóza.
Vnější dráha[upravit | editovat zdroj]
Začíná navázáním DR L (Death Receptor ligand) na Death Receptor, potažmo Fas L na Fas receptor a následnou trimerizací těchto receptorů (ligand se tam vezme buď díky apoptózu spouštějící buňce anebo apokrinní sekrecí, mezi apoptózu spouštějící faktory dále patří cytokiny, růstové faktory, hormony, toxiny). Přes protein FADD se k těmto receptorům váže homodimer iniciátorové prokaspasy 8 nebo 10, který se po aktivaci DR proteolyticky aktivuje na aktivní homodimer kaspas. Celý tento komplex se nazývá DISC (Death inducing signaling complex). Homodimer kaspas má 2 úlohy: aktivovat exekutivní prokaspasy 3, 7 a štěpit Bid protein na t-Bid protein. Kaspasa 3 pak ještě štěpí prokaspasu 6. Kaspasy 3, 6, 7 jsou exekutorové proteasy vlastní apoptózy.
Vnitřní dráha[upravit | editovat zdroj]
Neboli mitochondriální. Díky změně propustnosti vnitřní mitochondriální membrány se uvolňuje cytochrom c do cytosolu, kde se navazuje na inaktivní Apaf-1 protein a mění tak jeho konformaci. Po navázání ATP se komplex Apaf-1*cyt c*ATP sdružuje do pentameru, který je schopen navázat prokaspasu 9, která se po navázání mění na aktivní kaspasu 9. Celý složitý komplex se nazývá apoptosom. Tento apoptosom je schopen přeměnit prokaspasy 3, 7 na kaspasy 3, 7.
Změna propustnosti mitochondriální membrány je regulována rodinou Bcl proteinů. Proapoptotické Bax, Bak tvoří homodimery nebo heterodimery, které znamenají propustnost vnitřní mitochondriální membrány. Ta by však měla ve zdravé buňce být nepropustná, a proto existují anti-apoptotické proteiny Bcl-2, Bcl-xl, které s Bak, Bax tvoří heterodimery Bax/Bcl-2 a tyto jsou nepropustné. Zvýšené hladiny Bcl-2 byly nalezeny prvně u B lymfomu (B-Cell Lymphoma).
Vnitřní dráha je indukována nedostatkem O2 a živin, virovou infekcí, glukokortikoidy, teplem, radiací (poškození DNA či mitochondrií).
Poruchy signalizace[upravit | editovat zdroj]
Ztráta aktivačního signálu[upravit | editovat zdroj]
Může docházet buď ke snížení exprese DR, anebo jsou syntetizovány nefunkční, jako tzv. decoy receptory. Těmto chybí cytosolová doména DD, takže se nemůže navázat ani FADD a aktivace DISCu je tak znemožněna.
Signální přesmyk[upravit | editovat zdroj]
TRADD (Tumor necrosis factor Receptor Associated Death Domain) nenaváže požadovaný FADD (Fas Associated Death Domain), který je schopen vázat prokaspasu 8. Namísto toho se TRADD naváže na TRAF (TNF Receptor Associated Factor), který přes kaskádu několika kináz exprimuje transkripční faktor NFkB. Účinek NFkB spočívá v aktivaci antiapoptotických faktorů XIAP, FLIP i Bcl-2. Existují domněnky, že negativně ovlivňuje vlastní průběh apoptózy.
Inaktivace DISCu proteiny FLIP[upravit | editovat zdroj]
Protein FLIP má velmi podobnou strukturu prokaspase 8, obsahuje doménu DED, kterou se naváže na FADD protein a zabere místo jedné nebo dvěma prokaspasám 8 v DISCu. Homodimery se tedy nemohou tvořit ani se proteolyticky aktivovat. Tato inhibice je přímo úměrná koncentraci proteinu FLIP. Není na místě hned propadat zoufalství, i při nedostatečné aktivaci kaspasy 8 tato dokáže alespoň štěpit proteiny v okolí DISCu, např. protein Bid. Tento pak jako tBID eliminuje protein Bcl-2 a tím způsobí únik cytochromu c z mitochondrií.
Inhibitory Kaspas[upravit | editovat zdroj]
IAP (Inhibitors of Apoptosis Proteins) přímou vazbou na aktivní místa prokaspas zabraňují jejich aktivaci na kaspasy. Jsou to například HIAP, XIAP, SURVIVIN, LIVIN. Zvýšená exprese SURVIVINu byla prokázána u mnoha typů nádorů.
Poruchy mitochondriální signalizace spojené s tumor supresorovým p53[upravit | editovat zdroj]
Při poškození DNA dochází k transkripci genu TP53, jehož produkt je transkripční faktor p53. Protein p53 má klíčovou roli v potlačení nádorových procesů. Za prvé expresí p21, GADD45 staví buněčný cyklus, za druhé zvýšením exprese Bax, PUMA a potlačením Bcl-2 výrazně napomáhá k uvolnění cytochromu c a dalších proapoptotických faktorů z mitochondrií. (Pozměnění poměru Bax/Bcl-2.) Dalším proapoptotickým účinkem je upregulace FAS, DR5 nebo Apaf 1.
| Funkce proapoptotických faktorů uvolněných z mitochondrií | |
|---|---|
| faktor | funkce |
| Cytochrom c | aktivace apoptosomu (viz výše) |
| SMAC/DIABLO | Představuje další propojení vnější a vnitřní dráhy tím, že inaktivuje XIAP, který by rád inhiboval kaspasu 3. Tato interakce má velký význam, neboť kaspasa 3 pozitivní zpětnou vazbou dále štěpí XIAP. |
| Endonukleasa G | štěpí DNA při na kaspasách nezávislé apoptóze |
| HtrA2 | je hlavním IAP antagonistou, brání tak inaktivaci kaspas |
| AIF | Apoptosis Inducing Factor působí při na kaspasách nezávislé apoptóze, po uvolnění z mitochondrií indukuje kondensaci chromatinu a fragmentaci DNA. |
Další možnosti ovlivnění apoptózy[upravit | editovat zdroj]
Bodovou mutací Ras genu může dojít (přes MAP kinasy) k nadměrné aktivaci Akt kinasy. Tato je všeobecně spojována s přežitím buňky. Zeslabuje vnitřní aktivaci apoptózy fosforylací kaspasy 9, fosforylací Bad (fosforylace u těchto proteinů znamená inaktivaci). Také inaktivuje Fas L. Také přes IKK kinasu pozitivně ovlivňuje NFkB.
Signalizace apoptózy je velmi komplikovaný proces regulovaný mnoha proteiny. Naštěstí existuje spousta "sichrů", které v případě selhání prvního mohou zaskočit, ať už se jedná o vnitřní a vnější aktivaci a jejich vzájemné propojení nebo o caspase independent (na kaspasách nezávislou) apoptózu. Nádorový proces je mnohonásobný a jediná mutace dozajista nestačí k potlačení apoptózy. Přesto je třeba mít na paměti p53 a Bcl rodinu proteinů, jejichž defekty mohou být z hlediska onkogeneze fatální.