Kaspázy
Kaspázy[1][2] jsou rodina proteáz s cysteinem v aktivním místě, které štěpí peptidovou vazbu specificky za aspartátem (odtud anglický název caspase: cysteinyl aspartate specific protease). Objeveny a studovány byly nejprve na modelovém organismu háďátka obecného (Caenorhabditis elegans, produkty jeho genů ced – cell death abnormal) v souvislosti s ontogenezí, během níž fyziologicky probíhá apoptóza (např. u synapticky izolovaných neuronů, u některých živočichů při vývoji prstů atd.). Pro jejich význam v základních buněčných funkcích si geny, které je kódují, udržely v průběhu evoluce velmi konzervativní sekvence.
Rozdělení[upravit | editovat zdroj]
U člověka je známo dvanáct kaspáz[3], z nichž se sedm vyskytuje v apoptické kaskádě, zatímco ostatní souvisí s cytokiny buněčného cyklu, zánětem a jinými procesy.
Kaspázy zapojené v apoptické kaskádě[upravit | editovat zdroj]
- Iniciační – jsou na začátku aktivační kaskády, mají prodoménu dlouhou 129–219 aminokyselinových zbytků
- kaspáza-8 a -10: před aktivací obsahují sekvenci označovanou jako DED (death-effector domain; cca 80 AMK), která umožňuje vazbu na adaptorní protein, jenž vytvoří komplex dvou kaspáz, aby mohlo dojít k vzájemnému aktivačnímu štěpení;
- kaspáza-2 a -9: před aktivací obsahuje sekvenci CARD (caspase recruitment domain; cca 90 AMK)
- Efektorové – kaspáza-3, kaspáza-6 a kaspáza-7 – jsou koncovou částí aktivační kaspázy, provádějí aktivaci samotného procesu apoptózy. Jako substrát jim slouží např. aktiny (čímž se mění cytoskelet), lamininy (jaderná membrána), proteiny související s regulací buněčného cyklu (např. Wee1, cyklin A, ATM, p21Cip, pRb), proteiny účastnící se replikace DNA (např. topoizomeráza I, Mcm3), transkripce (např. Sp-1, NF-κD) a přenosu signálu (např. RasGAP, kináza C). Samotné morfologické změny, které tyto děje působí, zatím ovšem nebyly podrobně prostudovány[1]. Účastní se také degradace DNA, protože aktivují DNázu nazývanou CAD (caspase activated DNase) tak, že štěpí ICAD (inhibitor of caspase activated DNase), který je již od protein foldingu navázán na CAD a brání její funkci. Po uvolnění z CAD-ICAD komplexu vstupuje CAD do jádra a provede fragmentaci DNA.[4]
Poznámka: Mezi sekvence rozpoznávané kaspázami patří kromě CARD a DED i DD a další; obsahují je nejen kaspázy samotné, ale i jejich adaptorní proteiny, receptory, substráty atd.
Mechanismus aktivace[upravit | editovat zdroj]
Kaspázy jsou exprimovány v neaktivní formě, jako tzv. prokaspázy – dimery, které mají v každém meru část α a β řazeny za sebou a před vlastní molekulou připojenou sekvenci aminokyselin, označovanou jako prodoména (na jednom řetězci případně nahrazenou sekvencí 2× DED nebo CARD). Jejich specifickou vlastností je, že jedna kaspáza může aktivovat druhou. Jsou totiž uspořádány tak, že po štěpení peptidické vazby za aspartátem v jedné prokaspáze se uvolní prodoména a zároveň se od sebe oddělí část α a β za vzniku aktivního heterotetrameru α2β2.
Vlastní štěpení probíhá mechanismem podobným katalýze serinových proteáz (jako nukleofil zde na místo kyslíku vystupuje síra). V aktivním místě enzymu jsou blízko sebe zbytek cysteinu a zbytek histidinu. Zbytek histidinu přijme od -SH skupiny cysteinu hydron a tím ji aktivuje. Záporně nabitá síra nukleofilně atakuje karbonyl peptidové vazby aspartátu a následující aminokyseliny štěpeného proteinu, čímž na sebe aspartát naváže. Histidin přesune hydron na aminoskupinu následující aminokyseliny, čímž dojde k vlastnímu štěpení peptidové vazby a část proteinu končící aspartátem zůstane navázaná na cysteinu, zatímco část začínající následující aminokyselinou se oddělí. Následně probíhá hydrolýza vazby mezi sírou cysteinu a uhlíkem aspartátu, a proteáza se tak regeneruje.
Aktivace apikálních (iniciačních) kaspáz je děj ovšem složitější, jelikož adaptorní proteiny nejsou specifickými proteázami a nemohou tedy iniciační kaspázu štěpit podobně jako ona aktivuje kaspázu efektorní. Jako nejpravděpodobnější teorie se jeví mechanismus, při němž adaptorní protein naváže (např. na apoptozóm či jemu podobnou strukturu) dvě iniciační prokaspázy a změní jejich konformaci tak, aby se navzájem aktivovaly. K prokázání této teorie je však ještě nutné vysvětlit určité nesrovnalosti[5].
Vnější dráha aktivace[upravit | editovat zdroj]
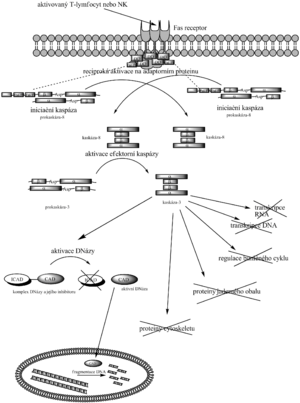
Vnější dráha aktivace apoptické kaskády kaspáz je nejčastěji popisována jako cesta vedoucí přes Fas receptor a aktivaci prokaspázy-8. Je spouštěna NK-buňkami nebo aktivovanými T-lymfocyty, které mají ve své membráně Fas ligand. Po přiblížení k buňce, která má podstoupit apoptózu, se Fas ligand naváže na její Fas receptor. To je transmembránový protein, který po navázání Fas-L vytvoří komplex z kaspázy-10, molekul kaspázy-8 a jejich adaptorního proteinu, jenž se postará o vhodnou konformaci kaspázy-8, která se recipročně štěpí a tím aktivuje. Ve zjednodušeném schématu kaspáza-8 aktivuje prokaspázu-3 na kaspázu-3, která jako efektorní enzym přenese finální signál k začátku apoptózy (laminy, CAD a další).
Vnitřní dráha aktivace[upravit | editovat zdroj]
Vnitřní dráha aktivace souvisí s poškozením buňky. Jedním z mechanismů indukce apoptózy po poškození je uvolnění cytochromu c z mitochondrie. Ten putuje do cytosolu a aktivuje adaptorní protein nazývaný Apaf-1, který zapříčiní aktivaci prokaspázy-9 na kaspázu-9, jež zase aktivuje efektorní kaspázy. Tato cesta je regulována na úrovni vazby cytochromu c a Apaf-1 proteiny z rodiny Bc-2: apoptózu podporuje Bad (inaktivuje inhibitory), Bax a Bak (napomáhají uvolnění cytochromu c), zatímco Bcl-2 a Bcl-XL ji inhibují (bráněním uvolnění cytochromu c). Dalším způsobem regulace jsou proteiny z rodiny IAP (inhibitor of apoptosis family), které inhibují aktivaci kaspáz, případně přímo jejich aktivitu. Toho mohou využívat např. viry, aby zabránily napadené buňce v apoptóze.
Vnitřní dráhu může také spustit poškození DNA. Signál je většinou převeden via gen p53, který aktivuje transkripci genů, jež kódují proteiny podporující uvolnění cytochromu c z mitochondrie.
Odkazy[upravit | editovat zdroj]
Reference[upravit | editovat zdroj]
- ↑ a b VOET, Donald a Judith VOET. Biochemistry. 3rd vydání. John Wiley & Sons Inc, 2004. 1616 s. ISBN 0-471-19350-X.
- ↑ ALBERTS, Bruce, Alexander JOHNSON a Julian LEWIS, et al. Molecular Biology Of The Cell [online] . 4th vydání. USA : Garland Science, 2002. Dostupné také z <https://www.ncbi.nlm.nih.gov/books/NBK26873/>. ISBN 0-8153-3218-1.
- ↑ HUGO Gene Nomenclature Committee. Gene Nomenclature Committee [online]. ©2010. [cit. 5.5.2010]. <https://www.genenames.org/>.
- ↑ NAGATA, Shigekazu. Apoptotic DNA Fragmentation – minireview. Experimental Cell Research [online]. 2000, vol. 256, s. 12-18, dostupné také z <http://www.sciencedirect.com/science/journal/00144827>. ISSN 0014-4827.
- ↑ Advances in Experimental Medicine and Biology, Vol. 615. . Programmed Cell Death in Cancer Progression and Therapy, Caspase Mechanism [online] . XIV vydání. Springer, 2008. 356 s. Dostupné také z <https://www.springer.com/gp/book/9781402065538>. ISBN 978-1-4020-6553-8.
Související články[upravit | editovat zdroj]
Doporučená literatura[upravit | editovat zdroj]
- POP, Cristina a Guy S. SALVESEN. Human Caspases: Activation, Specificity, and Regulation. The Journal of Biological Chemistry [online]. 2009, vol. 284, s. 21777-21781, dostupné také z <http://www.jbc.org/content/284/33/21777.abstract>. ISSN 1083-351X.