Vztahy mezi acidobazickou rovnováhou a ionogramem
Vztahy mezi acidobázickou rovnováhou a metabolismem hlavních iontů rozdělíme pro názornost do dvou skupin:
- Výměna protonů za jiné kationty
- Udržování elektroneutrality, tedy rovnováha mezi koncentracemi hydrogenuhličitanů a ostatních iontů
Výměna protonů za kationty draslíku a vápníku[upravit | editovat zdroj]
Draslík a acidobazická rovnováha[upravit | editovat zdroj]
Hovoří-li se o krátkodobém udržování acidobázické rovnováhy, mluví se především o pufrech krve – tedy zejména o hydrogenuhličitanovém a hemoglobinovém systému. Zcela obdobně se však chovají i intracelulární pufry. Podílejí se na nich hlavně hydrogenuhličitany, bílkoviny a fosfáty.
Snadno si můžeme představit, že při acidémii bude část „nadbytečných“ protonů vstupovat do buněk, v nichž se bude pufrovat. Tím se přes plasmatickou membránu přenesl kation; tato změna by tedy sama o sobě vedla ke změně membránového potenciálu. Namísto protonu proto z intracelulárního do extracelulárního prostoru přestoupí jiný kation. Protože vodivost plasmatické membrány je z hlavních iontů nejvyšší pro K+, bude to především draslík.
Acidémie popsaným mechanismem povede k hyperkalemii. Nezvyšuje se celkové množství draslíku v organismu, jen se mění jeho distribuce mezi kompartmenty. Z hlediska organismu jako celku bude dokonce důsledkem acidémie deplece kalia, protože se zvýší jeho renální ztráty (takže těžší a déletrvající acidémie bude doprovázena deplecí kalia při současné hyperkalemii).
Zcela analogicky provází alkalémii hypokalemie. Celý mechanismus však funguje i obráceně: hyperkalemie způsobí acidémii a hypokalemie naopak alkalémii. Zjednodušeně si můžeme představit, že draselné kationty se na plasmatické membráně směňují za protony.
Vápník a acidobazická rovnováha[upravit | editovat zdroj]
Podobně, jako se směňuje proton za draselný kation, mění se také protony za vápenatý kation. Klíčovou roli v tomto mechanismu hrají plasmatické bílkoviny.
Bílkoviny krevní plasmy se chovají jako pufry, především díky karboxylovým skupinám a aminoskupinám. Zabývejme se chováním karboxylových skupin:
V kyselém prostředí jsou karboxylové skupiny v protonovaném, nedisociovaném stavu (-COOH). Při alkalizaci začnou pufrovat, dochází k jejich disociaci na karboxylát -COO-. Karboxylát dokáže velmi účinně vázat dvojmocné kationty, zejména Ca2+, zejména pokud je několik karboxylátových skupin blízko sebe (což je u bílkovin běžné). Znamená to tedy, že při změně pH nedochází ke změně -COOH na -COO- a obráceně, ale ke složitějšímu ději, který je znázorněn na obrázku:
Můžeme také říci, že na pH prostředí záleží, jaká část vápníku bude ionizovaná a jaká část bude neionizovaná. I v tomto případě můžeme celý děj shrnout zjednodušeným tvrzením, že na plasmatických bílkovinách dochází ke směně protonů a vápenatých iontů.
Praktickým důsledkem je, že alkalémie vede k ionizované hypokalcémii, acidémie naopak k ionizované hyperkalcémii. Celková kalcémie se nemění, musíme si však uvědomit, že právě ionizované kalcium je metabolicky aktivní, zejména pokud jde o membránové děje.
Na patogenezi hysterického záchvatu se podílí psychogenně podmíněná hyperventilace. Vede k hypokapnii a tím i k respirační alkalóze a alkalémii. Výše popsaným mechanismem dochází k poklesu koncentrace ionizovaného kalcia, což má za následek zvýšení neuromuskulární dráždivosti. Psychogenní záchvat se tím dále prohlubuje, uzavírá se bludný kruh. Výsledkem bývá pád s křečemi a apnoickou pauzou. Během krátkého bezdeší se upraví pCO2, pH se vrátí k normě, stejně tak stoupne i ionizovaná kalcémie a epizoda končí. V rámci první pomoci se postiženým dává dýchat do sáčku — to je dostatečné pro udržení saturace kyslíkem, zabrání se však excesivním ztrátám CO2.
Řízené hyperventilace jako prostředku ke zvýšení neuronální excitability se využívá i cíleně, například během zaznamenávání EEG.
Ionizovaná hyperkalcémie při acidémii vede ke snížení neuromuskulární dráždivosti, letargii, slabosti, snížení motility GIT[1].
Hydrogenuhličitanový anion a ostatní hlavní ionty[upravit | editovat zdroj]
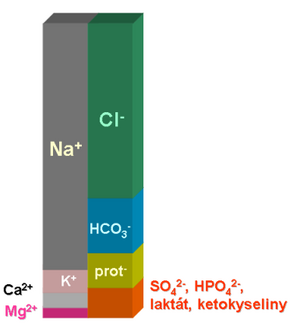
Vztahy mezi acidobazickou rovnováhou a iontovým hospodářstvím jsou těsně provázané. Hlavním důvodem je skutečnost, že jedna část hydrogenuhličitanového pufru nemá náboj (H2CO3 čili CO2), zatímco druhá složka je nabitá (HCO3-). Hydrogenuhličitanový anion proto musí být v rovnováze s ostatními ionty, aby byla zachována elektroneutralita vnitřního prostředí. Pro parciální tlak oxidu uhličitého nic takového neplatí, jeho regulace může být do značné míry nezávislá. Přitom podle Henderson-Hasselbalchovy rovnice pH vnitřního prostředí závisí na poměru koncentrace hydrogenuhličitanů a parciálního tlaku oxidu uhličitého.
Všimněme si, že koncentrace většiny hlavních iontů jsou buď přesně regulované, neboť jejich změna by měla závažné funkční důsledky (Na+, K+, Cl-), nebo organismus naopak disponuje jen velmi omezenými možnostmi je rychle ovlivnit (koncentrace bílkovin, ketokyselin, sulfátů a fosfátů). Přitom změní-li se koncentrace některého iontu v důsledku nějakého patologického pochodu, musí být tato změna kompenzována změnou koncetrace dalšího iontu, aby byla zachována elektroneutralita. Často kompenzace spočívá ve změně koncentrace hydrogenuhličitanů.
Při zvracení se se žaludeční šťávou ztrácí velké množství Cl-. Koncentrace ostatních hlavních iontů se nemění. Aby byla zachována elektroneutralita, bude nedostatek aniontů doplněn zvýšením koncentrace hydrogenuhličitanů. Ventilace přitom bývá zachována, pCO2 se nemění. Znamená to, že dojde ke změně poměru v Henderson-Hasselbalchově rovnici ve prospěch konjugované báze a rozvíjí se tzv. hypochloremická alkalóza.
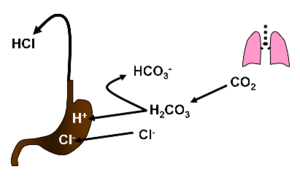
Bylo by zavádějící interpretovat metabolickou alkalózu při zvracení jako důsledek ztráty protonů s žaludeční kyselinou. Ukáže se to, budeme-li se zabývat původem a osudem jednotlivých iontů. Při sekreci HCl transportují H+ aktivně parietální buňky žaludeční sliznice protonovou pumpou. Cl- přechází na luminální stranu pasivně, aby byla zachována elektroneutralita celého děje. Zdrojem protonů je disociace kyseliny uhličité; H+ se secernuje, hydrogenuhličitan se vrací zpět do krve. Sumárně tedy můžeme celý děj popsat jako nahrazení chloridů v krvi za hydrogenuhličitany, jak jsme učinili v obecném výkladu výše.
Obecně lze doporučit, aby se při úvahách o důsledcích nějakého pochodu na acidobázickou rovnováhu posuzovaly především změny koncentrací hlavních iontů a jejich vyrovnání změnou koncentrace hydrogenuhličitanu. Změna pH je až druhotná v důsledku změny poměru v Henderson-Hasselbalchově rovnici. Musíme mít na paměti, že koncentrace protonů je o mnoho řádů nižší, než jsou koncentrace ostatních složek ionogramu. Eventuální ztráta nebo doplnění protonů je okamžitě vyrovnána pufrovacími mechanismy, jejichž kapacita je — vzhledem ke koncentraci samotných protonů — obrovská.
Odkazy[upravit | editovat zdroj]
Související články[upravit | editovat zdroj]
Reference[upravit | editovat zdroj]
- ↑ VEJRAŽKA, Martin. Poruchy acidobazické rovnováhy [přednáška k předmětu Patobiochemie 3, obor Všeobecné lékařství, 1. lékařská Univerzita Karlova]. Praha. 24.11.2015.