Lipáza
(přesměrováno z Lipasa)
Lipáza (triacylglycerolacylhydroláza, EC 3.1.1.3) je glykoprotein se 420 449 aminokyselinovými zbytky a molekulovou hmotností 46 000–56 000 u pankreatické lipázy a 32 000–39 000 u sérové lipázy.
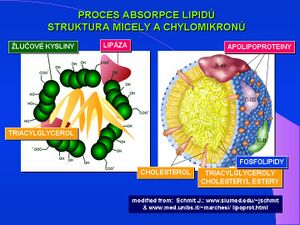
Jde o hydrolytický enzym štěpící triacylglyceroly s mastnými kyselinami o delším řetězci než 12 uhlíků, v přítomnosti žlučových kyselin štěpí tuk na monoacylglyceroly a diacylglyceroly. Predilekčně jsou odštěpovány mastné kyseliny v polohách sn-1 a sn-3. Tak jako α-amyláza je i lipáza produkována žlázovými buňkami pankreatu a secernována do střevního lumen v pankreatické šťávě. Koncentrační gradient mezi pankreatickou tkání a sérovou lipázou je cca 20 000:1.
Pro enzymovou hydrolýzu je nezbytný serin v řetězci Asp-His-Ser; pH optimum je mezi 7,5 a 10, v závislosti na podmínkách reakce; pI hodnota popsaných forem enzymu je v rozmezí 5,80 a 7,4. Kromě pankreatické lipázy existují další formy triacylglycerolové lipázy, např. lipáza jaterní, kterou lze odlišit inaktivcí atoxylem (pankreatická lipáza je rezistentní).
Stanovení aktivity lipázy[upravit | editovat zdroj]
Stanovení aktivity lipázy zahrnuje různé postupy:
- enzymové štěpení přirozeného substrátu;
- enzymové členění chromogenních a fluorogenních substrátů;
- metody imunologické (ELISA, latexová aglutinace).
Nejčastěji se používá nefelometrických a turbidimetrických postupů založených na štěpení přirozeného substrátu triacylglycerolu. Většina souprav pro enzymové stanovení lipázy obsahuje i ko-lipázu. Turbidimetrické stanovení aktivity lipázy je založeno na vyčeření olejové emulze působením lipolytické aktivity. Tento proces však může být ovlivněn i dalšími složkami séra, např. tzv. vyčeřovacím faktorem pseudolipázou. Nejčastěji se jedná o cirkulující imunokomplexy typu IgM. Pro diferenciální stanovení sérové pankreatické lipázy vedle pseudolipázy s použitím standardního turbidimetrického postupu je vypracován postup založený na inaktivaci pseudoplipázy β-merkaptoetanolem, který vede k disociaci IgM komplexů. Novější chromogenní testy jsou založeny na enzymové kaskádě lipázy štěpící 1,2-diacylglycerol, glycerolkináze, glycerol-3-fosfátoxidáze a peroxidáze s chromogenním produktem. Zcela nový typ techniky stanovení pankreatické lipázy je založen na změně vodivosti roztoku uvolněním mastných kyselin ze substrátu – trioleinu; detekována je akustickým snímačem a měřenou veličinou je frekvenční odpověď.
- Normální hodnoty
-
- do 1 μkat/l [1]
Klinický význam[upravit | editovat zdroj]
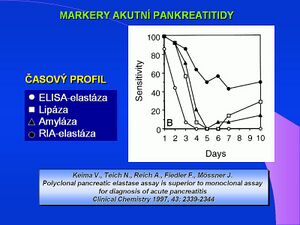
Klinický význam má stanovení lipázy především u akutní pankreatitidy, diagnosticky je však využíváno podstatně méně než stanovení α-amylázy. Důvodem jsou především technické problémy, které stanovení lipázy donedávna přinášelo. Z těchto důvodů vznikla celá řada velmi odlišných metodik k stanovení lipázy, jejichž výsledky lze velmi obtížně vzájemně porovnávat a standardizovat např. referenční meze. Diagnostický přínos stanovení sérové hladiny pankreatické lipázy je však podstatně vyšší než stanovení α-amylázy. Hladina lipázy v séru zůstává po atace akutní pankreatitidy zvýšena podstatně déle než hladina amylázy (popsána je zvýšená aktivita lipázy po 14 dnech). Vzhledem k tomu, že lipáza v séru má svůj původ především v buňkách pankreatu, poskytuje její stanovení podstatně vyšší specificitu, srovatelnou se specificitou pankreatického isoenzymu α-amylázy. V moči je lipáza běžnými posupy nedetekovatelná a nestanovuje se. Makroforma existuje u lipázy také, diagnosticky se však opět toto stanovení nepoužívá. Stanovení lipázy ve stolici jako marker pankreatické funkce se rovněž neosvědčilo. Vzhledem k vysoké specificitě je pro praxi, především v oblasti akutní medicíny, navržen imunologický průkaz lipázy jednoduchým latexovým testem.
Odkazy[upravit | editovat zdroj]
Zdroj[upravit | editovat zdroj]
- se svolením autora převzato z KOCNA, Petr. GastroLab : MiniEncyklopedie laboratorních metod v gastroenterologii [online]. ©2002. Poslední revize 2011-01-08, [cit. 2011-03-04]. <http://www1.lf1.cuni.cz/~kocna/glab/glency1.htm>.
Reference[upravit | editovat zdroj]
- ↑ Ústav lékařské biochemie a laboratorní diagnostiky 1. lékařské fakulty Univerzity Karlovy v Praze a Všeobecné fakultní nemocnice v Praze. Lipáza [online]. [cit. 2016-04-07]. <https://ulbld.lf1.cuni.cz/seznam-lab-vysetreni?vysetreni=1086>.
- CARROLL, Jennifer K, Brian HERRICK a Teresa GIPSON. Acute Pancreatitis: Diagnosis, Prognosis, and Treatment. American Family Physician [online]. 2007, vol. 75, no. 10, s. 1513-1520, dostupné také z <https://www.aafp.org/afp/2007/0515/p1513.pdf>. ISSN 0002-838X.
- YAMADAA, Magohei a Toshio FUJITA. New procedure for the measurement of pancreatic lipase activity in human serum using a thioester substrate. Clinica chimica acta. 2007, vol. 383, no. 1-2, s. 85-90, ISSN 0009-8981.
- AL-BAHRANI, Ahmed Z a Basil J AMMORI. Clinical laboratory assessment of acute pancreatitis. Clinica chimica acta. 2005, vol. 362, no. 1-2, s. 26-48, ISSN 0009-8981.
- SMITH, Ross C, James SOUTHWELL-KEELY a Douglas CHESHER. Should serum pancreatic lipase replace serum amylase as a biomarker of acute pancreatitis?. ANZ journal of surgery [online]. 2005, vol. 75, no. 6, s. 399-404, dostupné také z <https://onlinelibrary.wiley.com/doi/pdf/10.1111/j.1445-2197.2005.03391.x?cookieSet=1,>. ISSN 1445-1433.
- WALKOWIAK, J, A LISOWSKA a J PRZYSLAWSKI, et al. Faecal elastase-1 test is superior to faecal lipase test in the assessment of exocrine pancreatic function in cystic fibrosis. Acta paediatrica. 2004, vol. 93, no. 8, s. 1042-1045, ISSN 0001-656X.
- GRANDVAL, P, A DE CARO a J DE CARO, et al. Critical evaluation of a specific ELISA and two enzymatic assays of pancreatic lipases in human sera. Pancreatology. 2004, vol. 4, no. 6, s. 495-503, ISSN 1424-3903.
- WALKOWIAK, J, S NOUSIA-ARVANITAKIS a A LISOWSKA, et al. Serum lipase after secretin stimulation detects mild pancreatic involvement in cystic fibrosis. Journal of pediatric gastroenterology and nutrition. 2004, vol. 38, no. 4, s. 430-435, ISSN 0277-2116.
- WALKOWIAK, J, KH HERZIG a K STRZYKALA, et al. Porownanie przydatnosci oznaczania elastazy-1 i lipazy w stolcu w ocenie funkcji zewnatrzwydzielniczej trzustki u chorych na muskowiscydoze. Medycyna wieku rozwojowego. 2003, vol. 7, no. 2, s. 149-155, ISSN 1428-345X.
- STEINHAUER, JR, RW HARDY a CA ROBINSON, et al. Comparison of non-diglyceride- and diglyceride-based assays for pancreatic lipase activity. Journal of clinical laboratory analysis. 2002, vol. 16, no. 1, s. 52-55, ISSN 0887-8013.
- PANTEGHINI, Mauro, Ferruccio CERIOTTI a Franca PAGANI, et al. Recommendations for the routine use of pancreatic amylase measurement instead of total amylase for the diagnosis and monitoring of pancreatic pathology. Clinical Chemistry and Laboratory Medicine [online]. 2002, vol. 40, no. 2, s. 97-100, dostupné také z <https://www.degruyter.com/doi/abs/10.1515/CCLM.2002.017>. ISSN 1434-6621.
- TREACY, John, Anthony WILLIAMS a Renz BAIS, et al. Evaluation of amylase and lipase in the diagnosis of acute pancreatitis. ANZ Journal of Surgery [online]. 2001, vol. 71, no. 10, s. 577-82, dostupné také z <https://onlinelibrary.wiley.com/doi/pdf/10.1046/j.1445-2197.2001.02220.x>. ISSN 1445-1433.
- PEZZILLI, R, G TALAMINIL a L GULLO. Behaviour of serum pancreatic enzymes in chronic pancreatitis. Digestive and Liver Disease. 2000, vol. 32, no. 3, s. 233-237, ISSN 1590-8658.
- KEIM, V, N TEICH a F FIEDLER, et al. A comparison of lipase and amylase in the diagnosis of acute pancreatitis in patients with abdominal pain. Pancreas. 1998, vol. 16, no. 1, s. 45-49, ISSN 0885-3177.
- LESSINGER, JM, P ARZOGLOU a P RAMOS, et al. Preparation and characterization of reference materials for human pancreatic lipase: BCR 693 (from human pancreatic juice) and BCR 694 (recombinant). Clinical chemistry and laboratory medicine. 2003, vol. 41, no. 2, s. 169-176, ISSN 1434-6621.
- CHASE, CW, DE BARKER a WL RUSSELL. Serum amylase and lipase in the evaluation of acute abdominal pain. The American surgeon. 1996, vol. 62, no. 12, s. 1028-1033, ISSN 0003-1348.
- MALFERTHEINER, P a J ENRIQUE DOMÍNGUEZ-MUÑOZ. Clinical and laboratory diagnosis of acute pancreatitis. Annali italiani di chirurgia. 1995, vol. 66, no. 2, s. 165-170, ISSN 0003-469X.