Identifikace chromozomů
(přesměrováno z Cytogenetické vyšetření)
Barvení chromosomů[upravit | editovat zdroj]
Klasické barvení[upravit | editovat zdroj]
Chromosomy obarvené roztokem podle Giemsy-Romanovského jsou homogenně tmavé. Tento typ barvení umožňuje hodnotit počet a hrubou stavbu chromosomů, zlomy a nestabilní přestavby (u jedinců vystavených působení klastogenních činitelů). Klasické barvení se používá i u pacientů s poruchami reparace poškozené DNA (Fanconiho anémie, ataxia-telangiectasia, Nijmegen-breakage syndrom).
G pruhy[upravit | editovat zdroj]
G pruhování je nejčastěji rutinně používané barvení v cytogenetických laboratořích. Vzor tvořený příčnými pruhy se objeví na chromosomech inkubovaných v trypsinu po obarvení roztokem podle Giemsy-Romanovského. Počet pruhů závisí na stupni kondenzace chromosomů. V metafázi je na chromosomech 400–450 pruhů. V prometafázi je v karyotypu identifikovatelných okolo 850 pruhů. Tmavě se barví heterochromatinové oblasti tvořené DNA bohatou na adenin a thymin. Světlé pruhy odpovídají euchromatinu bohatému na guanin a cytosin.
R pruhy[upravit | editovat zdroj]
Metoda R pruhování je založena na působení vysoké teploty (87 °C) a následném obarvení roztokem podle Giemsy-Romanovského. Výsledný pruhový vzor je reverzní k G pruhování (G negativní).
AgNOR barvení[upravit | editovat zdroj]
Toto barvení se využívá ke sledování variant sekundární konstrikce akrocentrických chromosomů. Dusičnan stříbrný se selektivně vysráží v oblasti nukleolárního organizátoru.
C barvení[upravit | editovat zdroj]
Metoda slouží ke zobrazení konstitutivního heterochromatinu – satelitní DNA. U člověka je variabilita ve velikosti konstitutivního heterochromatinu na dlouhých ramenech chromosomů 1, 9, 16 a Y.
Speciální metody[upravit | editovat zdroj]
SCE (Sister Chromatide Exchange)[upravit | editovat zdroj]
Symetrická výměna úseků DNA mezi sesterskými chromatidami pozorovatelná na metafázních chromosomech. Za fyziologických podmínek dochází při každé replikaci ke 4–6 SCE. UV záření a působení genotoxických látek indukuje zvýšení počtu SCE v buňkách.
K vizualizaci SCE se využívá „harlequinská“ technika, založená na rozdílném zbarvení sesterských chromatid. Lymfocyty periferní krve se kultivují v mediu s BrdU (5-bromo 2-deoxyuridin – analog thyminu). Při replikaci se BrdU inkorporuje do nově vznikajících řetězců DNA namísto thyminu. V metafázi následujícího buněčného cyklu mají chromosomy v jedné sesterské chromatidě v obou vláknech DNA substituovaný BrdU a ve druhé chromatidě jedno vlákno původní a druhé s BrdU. Přítomnost BrdU v DNA snižuje její schopnost vázat některá barviva a po barvení např. Giemsovým barvivem jsou světlejší chromatidy s BrdU.
Podle zbarvení chromatid je v kultuře možné odlišit metafáze 1., 2. a 3. dělení.
Test SCE in vitro na lidských lymfocytech se využívá k testování klastogenních účinků látek. Tento test je citlivější než hodnocení ZCHA. In vivo způsobuje zvýšení počtu SCE např. kouření, a některá cytostatika (na bázi alkylačních látek). U jedinců s Bloomovým syndromem je vyšetření SCE rutinně používanou vyšetřovací metodou (počet výměn i více než 100 na mitózu).
Fragilní-X[upravit | editovat zdroj]
V lidském karyotypu je známa řada fragilních míst – oblastí častého vzniku zlomů. Objevují se na metafázních chomosomech po expozici určitými látkami nebo při růstu v deficitních médiích. Většinou jejich přítomnost nesouvisí s patologickým fenotypem. Určitou výjimku tvoří fragilní místo Xq27.3 (FRAXA) u pacientů se syndromem fragilního X.
Xq27.3 je folát senzitivní místo, kreré je možno vizualizovat po kultivaci v mediu s nízkým obsahem kyseliny listové, příp. za přítomnosti antagonistů kys. listové FudR (5´-fluoro 2´-deoxyuridin) nebo metotrexátu.
Cytogeneticky lze za optimálních laboratorních podmínek (a při troše štěstí) diagnostikovat přítomnost fra Xq27.3 jak u postižených mužů tak u žen přenašeček.
Syndrom fragilního X je podmíněn expanzí tripletové repetice CGG v prvním exonu genu FMR1 (Fragile X Mental Retardation 1). V současné době se pro diagnostiku FRAXA cytogenetická diagnostika již nevyužívá a dává se přednost přímé DNA diagnostice zaměřené na počet repetic v daném genu.
V oblasti Xq28 leží ještě další folát senzitivní fragilní místa; FRAXE – spojené s mírnější mentální retardací a snad benigní FRAXF.
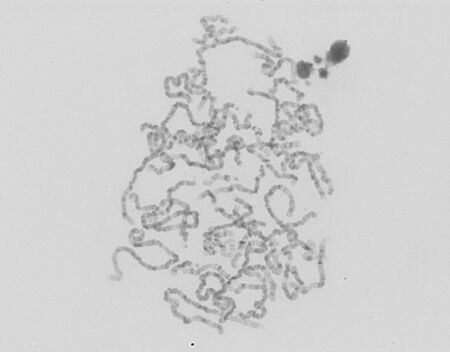
HRT (High Resolution Technique)[upravit | editovat zdroj]
Metoda HRT umožňuje analyzovat velmi dlouhé jen částečně spiralizované chromosomy. Speciální kultivační technika zahrnuje synchronizaci dělení buněčné kultury methotrexátem a následné zastavení dělení v prometafázi. Na chromosomech je možné identifikovat až 850 G-pruhů. Tato metoda je vhodná pro analýzu strukturních přestaveb malého rozsahu (např. mikrodelecí), v rámci rutinní diagnostiky se s ní ovšem dnes již nesetkáme, neboť byla kompletně nahrazena (ještě přesnější) metodou microarray.
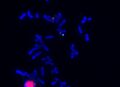
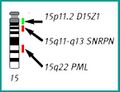
FISH (Fluorescent in situ hybridization)[upravit | editovat zdroj]
Metoda FISH využívá DNA sondy značené fluorescenčním barvivem k detekci specifických úseků DNA. FISH lze použít jako doplňkovou metodu při cytogenetickém vyšetření. Sondy se aplikují přímo na buněčný materiál (chromosomy v metafázi a prometafázi nebo interfázní jádra), není nutná izolace DNA. Preparáty se hodnotí pod fluorescenčním mikroskopem.
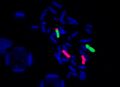
FISH – lokus specifická sonda, Prader-Willi
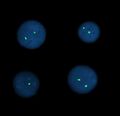
Interfázní FISH – α-satelitní sonda, mozaika 46XX/45X
Typy sond[upravit | editovat zdroj]
- Lokus-specifické sondy je možné použít pro jádra v interfázi i pro metafázní chromosomy. Slouží k vyšetřování mikrodelecí, subtelometrických přestaveb a amplifikací.
- Satelitní (centromerické, telometrické) sondy je možné použít pro jádra v interfázi i pro metafázní chromosomy. Užívají se k určení počtu jednotlivých chromosomů a k vyšetřování mozaicismu.
- Celochromosomové (malovací) sondy jsou vhodné pouze pro metafázní chromosomy. Slouží k hodnocení přestaveb chromosomů.
Nejčastěji používaná fluorescenční barviva[upravit | editovat zdroj]
- DAPI (4',6-diamidino-2-fenylindol) – k podbarvení preparátů (counterstaining).
- FITC (fluorescein-5-isothiokyanát) – zelený signál.
- TRITC (tetramethylrhodamin-5-isothiokyanát) – červený signál.