Hem
Hem je prostetická skupina hemoproteinů, která je tvořena tetrapyrrolovým jádrem, v jehož středu je navázán centrální ion Fe2+.
Hemoproteiny[upravit | editovat zdroj]
Hemoproteiny jsou chemické struktury zajišťující v organismu mnoho aerobních funkcí. Jejich prostřednictvím se kyslík nejen přenáší, ale i skladuje (hemoglobin, myoglobin). Dále se hemoproteiny podílejí na transportu elektronů pro tvorbu energie v dýchacím řetězci, využívají se pro syntézy a degradace stavebních nebo zásobních prvků (steroidy, lipidy) a k detoxikaci xenobiotik. Významná je také jejich úloha při kontrole oxidačního poškození.
Biosyntéza hemu[upravit | editovat zdroj]
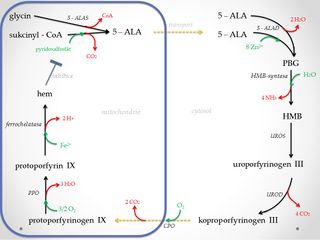
Biosyntéza hemu probíhá ve všech buňkách lidského těla. Nejvýrazněji se projevuje v erytroidních buňkách kostní dřeně (70–80%)[1] a buňkách jater (15%)[1]. Hem v prekurzorech erytrocytů se stává součástí transportního proteinu – hemoglobinu. V játrech je vestavován do enzymů z rodiny cytochromů P450 a v buňkách ostatních tkání je součástí pracovních enzymů (katalázy, peroxidasy, aj.). Vlastní biosyntetická dráha je katalyzována osmi enzymy, lokalizovanými v mitochondriích a cytosolu. Enzymy jsou vytvářeny za prvé jako >>housekeeping<< (provozní) varianty, přítomné v buňkách všech tkání, za druhé jako specifické varianty v rámci erytroidních buněk. Vznik jednotlivých izoforem enzymů je dán rozdílnou lokalizací genů na chromosomech v lidském genomu, nebo odlišnou expresí téhož genu.
1. Syntéza kyseliny 5-aminolevulové (5-ALA)[upravit | editovat zdroj]
Kyselina 5-aminolevulová vzniká kondenzací glycinu se sukcinyl-CoA a následnou dekarboxylací intermediátu této reakce. Průběh je katalyzován 5-ALA synthasou (ALAS) - enzymem lokalizovaným v matrix mitochondrií. Reakce se jako kofaktor účastní pyridoxal-5-fosfát, který na počátku tvoří s glycinem Schiffovu bázi. ALAS se vyskytuje ve dvou izoformách. ALAS-1 je přítomna ve všech buňkách, ALAS-2 je specifická pro erytroidní buňky. Aktivita ALAS je citlivá na přítomnost vitaminu B6. Tento krok je nejvýraznějším regulačním bodem celé syntézy.
2. Vznik porfobilinogenu (PBG)[upravit | editovat zdroj]
5-ALA přechází po ukončení své syntézy do cytosolu. Zde probíhá kondenzace a současná dehydratace 2 molekul 5-ALA za vzniku porfobilinogenu, což je monopyrrol biosyntetické dráhy hemu. Reakce je katalyzována 5-aminolevulát-dehydratasou (ALAD) (porfobilinogensynthasa). ALAD je oktamerní -SH metaloenzym obsahující osm molekul Zn2+. Vazebná místa pro Zn2+ jsou tvořena -S- cysteinovými ligandy a mohou být obsazena kationty těžkých kovů např. Pb2+, což vede k inhibici celé reakce.
3. Vznik hydroxymetylbilanu (HMB)[upravit | editovat zdroj]
Hydroxymetylbilan je lineární tetrapyrrol jehož syntéza je katalyzována HMB-synthasou. Podstatou reakce je postupná kondenzace čtyř porfobilinogenů (PBG) na dipyrromethanové skupině enzymu. Během procesu se uvolňují celkem čtyři molekuly amoniaku.
4. Vznik uroporfyrinogenu III[upravit | editovat zdroj]
Uroporfyrinogen-III-synthasa (UROS) katalyzuje cyklizaci HMB na uroporfyrinogen III. Jedná se o oktakarboxylát obsahující čtyři acetátové a čtyři propionové skupiny. Je prekurzorem pro vznik korinů (kobalamin) a chlorinů (chlorofyl).
5. Vznik koproporfyrinogenu III[upravit | editovat zdroj]
Koproporfyrinogen III vzniká postupnou dekarboxylací oktakarboxylátu (uroporfyrinogen III) na tetrakarboxylát. Reakce je realizována uroporfyrinogendekarboxylasou (UROD). Podstatou je přeměna čtyř acetátových zbytků postranních řetězců na methylové zbytky.
6. Vznik protoporfyrinogenu IX[upravit | editovat zdroj]
Koproporfyrinogen přechází zpět do mitochondrie. Zde je pomocí koproporfyrinogenoxidasy (CPO), lokalizované v mezimembránovém prostoru, oxidativně dekarboxylován na protoporfyrinogen IX. Během reakce se přeměňují dva propionáty (v pozici 2 a 4) na vinylové skupiny.
7. Vznik protoporfyrinu IX[upravit | editovat zdroj]
Protoporfyrin IX vzniká odštěpením šest H+ a šest elektronů pomocí protoporfyrinogenoxidasy (PPO) – integrálního proteinu vnitřní mitochondriální membrány. Její aktivní místo je orientováno do mezimembránového prostoru. Reakce se účastní molekuly kyslíku, na něž jsou předány vodíkové ionty za vzniku vody. Methylenové můstky protoporfyrinogenu IX se touto reakcí přeměňují na methinové můstky protoporfyrinu IX. Vzniká systém konjugovaných π-vazeb, který je příčinou zabarvení porfyrinových systémů.
8. Vznik hemu[upravit | editovat zdroj]
Závěrečnou reakcí biosyntézy je vestavba Fe2+ do struktury protoporfyrinu IX. Průběh je katalyzován ferrochelatasou (hemsynthasou), jejímž kofaktorem jsou proteinové molekuly s [2Fe - 2S] klastrem. Reakce probíhá na vnitřní mitochondriální membráně, enzym je přivrácen do matrix mitochondrie.
Odkazy[upravit | editovat zdroj]
Související články[upravit | editovat zdroj]
Použitá literatura[upravit | editovat zdroj]
- MURRAY, Robert, Daryl GRANNER a Peter MAYES, et al. Harperova biochemie. 4. české vydání. Jinočany : Nakladatelství H+H, 2002. 872 s. s. 354-360. ISBN 80-7319-013-3.
- MATOUŠ, Bohuslav, et al. Základy lékařské chemie a biochemie. 1. vydání. Praha : Galén, 2010. 540 s. ISBN 978-80-7262-702-8.
- KOOLMAN, Jan a Klaus-Heinrich RÖHM. Barevný atlas biochemie. 1. vydání. Praha : Grada, 2012. ISBN 978-80-247-2977-0.
Reference[upravit | editovat zdroj]
- ↑ a b MATOUŠ, Bohuslav a ET AL.. Základy lékařské chemie a biochemie. 1. vydání. Praha : Galén, 2010. 540 s. s. 225. ISBN 978-80-7262-702-8.