Juvenilní hyperbilirubinémie
Z WikiSkript
Juvenilní hyperbilirubinémie jsou z hlediska etiologického heterogenní skupinou onemocnění, která postihuje především dospívající populaci. Prevalence je relativně vysoká, v populaci dospívajících 2 - 6 %, s převahou chlapců. Začátek či zvýraznění hyperbilirubinémie v dospívání souvisí pravděpodobně se zvýšenou zátěží hepatocytů (asymptomatická EBV infekce, hormonální antikoncepce, abúzus alkoholu nebo experimentování s drogami). Dospívající s nově zachycenou hyperbilirubinémií často přicházejí s projevy zvýšené únavnosti, nespecifických zažívacích obtíží, nakupení infektů nebo intolerance silné zátěže při sportovním tréninku.[1]
- Dif. dg. nekonjugované hyperbilirubinémie
- Gilbertův syndrom – benigní, relativně časté AR dědičné onemocnění; snížená aktivita UGT1A1;
- Criglerův–Najjarův syndrom 2. typu – vzácné AR dědičné onemocnění; velmi nízká aktivita UGT1A1;
- hemolýza;
- Wilsonova choroba – AR dědičné degenerativní onemocnění s abnormálním střádáním mědi v játrech, mozku, rohovce a dalších orgánech;
- Deficit alfa 1-antitrypsinu – geneticky podmíněný defekt inhibitoru proteáz; jaterní onemocnění a plicní emfyzém.
- Dif. dg. konjugované hyperbilirubinémie
- Dubinův-Johnsonův syndrom – benigní AR dědičné onemocnění; hepatocelulární porucha sekrece konjugovaného bilirubinu do žluče;
- Rotorův syndrom – benigní AR dědičné onemocnění; porucha exkrece konjugovaného bilirubinu do žluče.
Bilirubin[upravit | editovat zdroj]
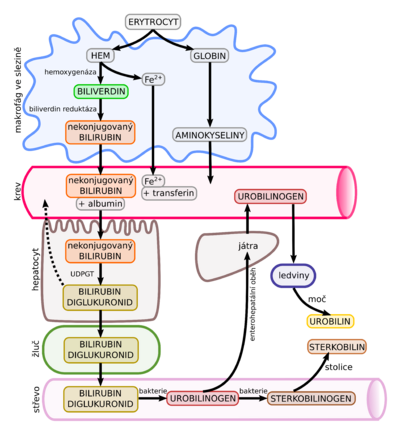
- Bilirubin je konečný degradační produkt hemoglobinu. Hlavním zdrojem jsou erytrocyty odstraněné z cirkulace a destruované retikuloendoteliálním systémem.
- Bilirubin (nekonjugovaný, nepřímý) je krvi vázán na albumin (pokud není překonána jeho vazebná kapacita), je rozpustný v tucích (→ usazuje se v tukových tkáních a CNS) → vychytáván játry → konjugován se 2 molekulami kyseliny glukuronové v endoplazmatickém retikulu hepatocytů, konjugace je katalyzována uridindifosfoglukuronosyltransferázu (UGT1A1) → konjugovaný, přímý bilirubin, rozpustný ve vodě, je transportován zpět do cytosolu → ze žlučového pólu hepatocytu pomocí kanalikulárního transportéru vylučován do žluči.[2]
Gilbertův syndrom[upravit | editovat zdroj]
- autozomálně recesivní, benigní hyperbilirubinémie;
- bylo zjištěno celkem 9 odlišných genových poruch;
- způsobená nejčastěji inzercí nukleotidů TA v TATA boxu genu pro uridindifosfoglukuronosyltransferázu (UGT1A1) – frekvence této alely genu UGT1A1 je v indoevropské populaci 35–40 %, tzn. v naší populaci je 11–16 % homozygotů pro prodloužený TATA box, ale jen část z nich má hyperbilirubinémii;
- mutace v promotorové oblasti genu → porucha iniciace transkripce → snížená aktivita UGT1A1 o 30 %;
- u někoho se navíc vyskytuje zkrácená dobu přežívání erytrocytů, tedy potenciálně vyšší produkce bilirubinu;
- cca třetina pacientů vykazuje poruchu transportu všech organických aniontů v hepatocytu, která se projevuje sníženým vychytáváním bilirubinu;
- manifestace někdy již v novorozeneckém věku protrahovaným novorozeneckým ikterem, který někdy imponuje jako žloutenka kojených dětí;
- typické klinické projevy: mírná izolovaná nekonjugovaná hyperbilirubinémie, většinou do 80 μmol/l, málokdy do 100 μmol/l, bez manifestní hemolýzy a bez známek jiné poruchy jaterních funkcí (kromě glukuronidace), bez makro- či mikroskopických změn jaterního parenchymu;
- historické diagnostické testy: tzv. hladový pokus (lačnění), testy s fenobarbitalem nebo kyselinou nikotinovou – nespecifické.[1]
Criglerův–Najjarův syndrom 2. typu[upravit | editovat zdroj]
- vzácná autozomálně recesivní choroba –různé mutace v strukturální části genu UGT1A1, které způsobí těžkou poruchu glukuronidace bilirubinu se zbytkovou aktivitou UGT1A1;
- výrazná nekonjugovaná hyperbilirubinémie (bilirubin 100–300 μmol/l);
- hyperbilirubinémii lze snížit enzymovými induktory (fenobarbital) a fototerapií.[1]
Hemolýza[upravit | editovat zdroj]
- izolovaná nekonjugovaná hyperbilirubinémie;
- pokles erytrocytů a hemoglobinu v krevním obrazu; zvýšené množství retikulocytů;
- snížení haptoglobinu ukazuje na zvýšenou hladinu volného hemoglobinu v krvi.[1]
Wilsonova choroba[upravit | editovat zdroj]
- AR dědičné degenerativní onemocnění – velké množství mutací;
- abnormální střádání mědi v játrech, mozku, rohovce a dalších orgánech;
- defekt genu, který je důležitý pro inkorporaci mědi do ceruloplazminu (resp. do apoceruloplazminu) a pro exkreci nadbytečné mědi do žluči;
- měď je toxická pro organely hepatocytů – způsobuje nekrózu buněk → steatóza jater → chronická aktivní hepatitida → jaterní cirhóza;
- při nekróze hepatocytů se nevázaná měď uvolňuje do oběhu a působí toxicky na erytrocyty a mozek (bazální ganglia), oční tkáně, ledviny, kosti atd.
- zpočátku asymptomatický průběh – pouze hromadění mědi v játrech a histologické změny;
- manifestace obvykle až po 12. roce věku ale i výrazně později: únava, nechutenství, pobolívání břicha při hepatomegalii, subikterus až ikterus;
- později příznaky z cirhotické přestavby: portální hypertenze, splenomegalie, ascites, krvácení z jícnových varixů, pavoučkovité névy, koagulační poruchy;
- neurologické příznaky: nesoustředění, lehký třes, dysartrie, dystonie, hyperkineze, zvýšená salivace, rigidita;
- oční manifestace: zelenohnědý Kayserův-Fleischerův prstenec na okraji rohovky na zadní straně Descemetovy membrány;
- vzácně probíhá pod obrazem fulminantního jaterního selhání: masivní nekrózy v játrech, velké množství mědi v oběhu, Coombs negativní hemolytická anémie s hemoglobinurií a multiorgánovým selháním;
- diagnostika: nízká až stopová hladina ceruloplazminu, zvýšené aminotransferázy a bilirubin, zvýšený odpad mědi v moči, molekulárně-genetické vyšetření, biopsie jater (kvantitativní stanovení mědi);
- léčba: chelační efekt D-penicillaminu s pyridoxinem (penicillamin vede k deficitu pyridoxinu), transplantace jater;
- neléčená Wilsonova choroba je progresivní a letální.[3]
Deficit alfa1-antitrypsinu[upravit | editovat zdroj]
- geneticky podmíněný defekt proteázového inhibitoru α1-antitrypsinu;
- různé fenotypy; klinicky nejvýznamnější je mutace PiZZ, která způsobuje plicní emfyzém a jaterní onemocnění (cirhóza, hepatom);
- není bráněno proteolytické aktivitě elastázy neutrofilů v plicním epitelu (+ kouření, znečištění vzduchu → CHOPN již ve 3. dekádě);
- již v novorozeneckém věku se může objevit cholestatický ikterus s acholickými stolicemi, pruritem a hepatosplenomegalií;
- jaterní onemocnění obvykle probíhá benigně;
- diagnostika: snížená sérová hladina α1-antitrypsinu; elektroforéza sérových bílkovin - snížená α-frakce;
- léčba u dospělých CHOPN: substituce rekombinantním syntetickým α1-antitrypsinem (bronchiálně či i.v.); při fulminantním jaterním postižení - transplantace jater;
- nejčastější geneticky podmíněné onemocnění jater dětského věku.[4]
Posthepatitická hyperbilirubinémie[upravit | editovat zdroj]
- ve většině případů akutního zánětu jater bez přechodu do chronicity dochází k normalizaci všech jaterních testů.
- v případě chronické hepatitidy je vedoucím základním laboratorním projevem elevace aminotransferáz a hyperbilirubinémie chybí, nebo je velmi mírná.
- u závažných jaterních onemocnění se předpokládá tzv. zkratový mechanizmus vzniku nekonjugované hyperbilirubinémi: zkraty mezi arteriálním a venózním řečištěm bez průtoku krve „očišťovací“ částí jaterního parenchymu mohou způsobit vzestup nekonjugovaného bilirubinu v séru.[1]
Dubinův-Johnsonův syndrom[upravit | editovat zdroj]
- benigní AR dědičné onemocnění;
- hepatocelulární porucha sekrece konjugovaného bilirubinu do žluče;
- diagnostikován obvykle kolem 10. roku věku;
- kolísavá hyperbilirubinémie (34-136 μmol/l) s 30-60% podílem konjugované složky;
- při akutním zhoršení: teploty, nevolnost, zvracení, bolesti břicha, tmavá moč, vybarvená stolice, hepatomegalie;
- diagnostika: konjugovaná hyperbilirubinémie, patologické vylučování barviv, která musí projít žlučovými kanálky (bromsulfoftalein), negativní cholecystografie, histologie jater s nahromaděním hnědého až červeného pigmentu v lyzozomech;
- léčba: pouze symptomatologická při akutním zhoršení, prognóza dobrá.[4]
Rotorův syndrom[upravit | editovat zdroj]
- benigní AR dědičné onemocnění;
- porucha exkrece konjugovaného bilirubinu do žluče;
- klinický obraz stejný jako při Dubinově-Johnsonově syndromu, ale chybí bolesti břicha;
- diagnostika: konjugovaná hyperbilirubinémie, patologické vylučování barviv, která musí projít žlučovými kanálky (bromsulfoftalein), pozitivní cholecystografie, histologie jater bez nahromadění pigmentu v lyzozomech;
- léčba: pouze symptomatologická při akutním zhoršení, prognóza dobrá.[4]
Laboratorní vyšetření[upravit | editovat zdroj]
- krevní obraz + diferenciál + retikulocyty (3×)
- haptoglobin (při hemolýze snížen)
- jaterní testy (AST, ALT, ALP, GMT), bilirubin celkový a konjugovaný
- Quickův test, APTT
- cholinesteráza, prealbumin
- ceruloplazmin (Wilsonova choroba),α1-antitrypsin (deficit)
- infekční hepatitidy A, B, C
- EBV, CMV, HSV
- toxoplazmóza
- imunoglobuliny, CIK, ANAb
Normální hladina sérového bilirubinu je 17–20 µmol/l.
- při hodnotě 20–30 µmol/l je indikována kontrola jaterních testů
- nad 30 µmol/l je vhodné podrobnější vyšetření
- průkaz hemolýzy – v krvi je 3× více retikulocytů než obvykle (norma je do 10 %)
- nekonjugovaná hyperbilirubinémie znamená, že konjugovaná frakce musí být zastoupena do 15 %.[5]
Odkazy[upravit | editovat zdroj]
Související články[upravit | editovat zdroj]
- Žloutenka (pediatrie) • Hyperbilirubinemie novorozenců a kojenců • Ikterus • Diferenciální diagnostika ikteru
Reference[upravit | editovat zdroj]
- ↑ a b c d e KABÍČEK, P a L BARNINCOVÁ. Juvenilní hyperbilirubinémie a její iniciální projevy v dorostovém věku. ČASOPIS LÉKAŘŮ ČESKÝCH [online]. 2007, roč. -, vol. -, s. 528–532, dostupné také z <http://www.prolekare.cz/pdf?id=2963>.
- ↑ LEBL, J, J JANDA a P POHUNEK, et al. Klinická pediatrie. 1. vydání. Galén, 2012. 698 s. s. 354. ISBN 978-80-7262-772-1.
- ↑ LEBL, J, J JANDA a P POHUNEK, et al. Klinická pediatrie. 1. vydání. Galén, 2012. 698 s. s. 364-365. ISBN 978-80-7262-772-1.
- ↑ a b c MUNTAU, Ania Carolina. Pediatrie. 4. vydání. Praha : Grada, 2009. s. 387-390. ISBN 978-80-247-2525-3.
- ↑ BENEŠ, Jiří. Studijní materiály [online]. ©2007. [cit. 2009]. <http://www.jirben.wz.cz/>.